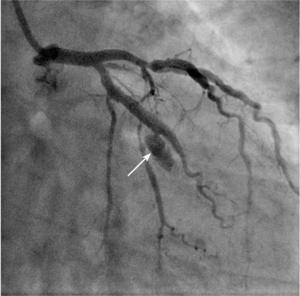
• typ II, gdy kontrast wydostaje się do przestrzeni pozanaczyniowej, tworząc ograniczony cień w mięśniu komory lub przestrzeni podnasierdziowej,
• typ III, gdy kontrast swobodnie wypływa do worka osierdziowego.
Do takich powikłań dochodzi zazwyczaj przy próbie rekanalizacji przewlekłej niedrożności naczynia (chronic total occlusion, CTO). W tego typu zabiegach często stosuje się sztywne, ostro zakończone prowadniki, czasami dodatkowo pokryte substancją hydrofilną, co ułatwia penetrację zwapniałej blaszki miażdżycowej. Perforacja naczynia prowadnikiem zwykle nie prowadzi do poważnych konsekwencji klinicznych, ponieważ jego średnica jest bardzo mała (ok. 0,3 mm). Jednak rozprężenie w tym miejscu cewnika balonowego prowadzi do rozerwania naczynia z dużym krwawieniem do worka osierdziowego i tamponadą serca. Inną przyczyną perforacji może być implantacja stentu, którego średnica znacznie przekracza wymiar światła naczynia. Szczególnie ryzykowna jest implantacja takiego stentu w zwapniałą, niepodatną zmianę. Wreszcie w związku z rozpowszechnieniem się prowadników polimerowych pokrytych substancją hydrofilną coraz częściej zdarzają się perforacje drobnych naczyń na obwodzie tętnicy wieńcowej. Zazwyczaj tego typu uszkodzenie nie niesie za sobą poważnych konsekwencji, jednak u pacjentów poddanych intensywnej terapii przeciwzakrzepowej może prowadzić do dużego krwawienia do worka osierdziowego. Ryzyko perforacji rośnie w przypadku stosowania technik ablacyjnych, takich jak rotablacja czy aterektomia kierunkowa.
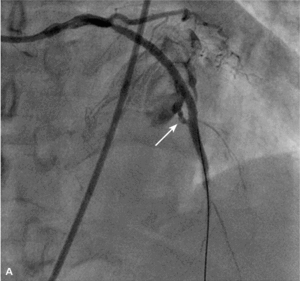
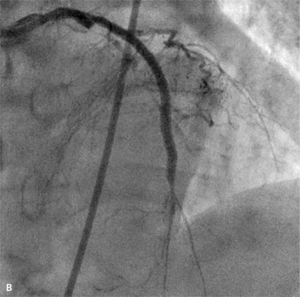
RYCINA 4. [A] Perforacja typu III po implantacji stentu do tętnicy zstępującej przedniej. [B] Ten sam pacjent. Zamknięcie miejsca perforacji za pomocą stentgraftu.
Tamponada serca jest najpoważniejszą konsekwencją perforacji tętnicy wieńcowej. W przypadku perforacji typu III należy natychmiast zamknąć uszkodzoną tętnicę za pomocą cewnika balonowego. Przy objawach tamponady trzeba nakłuć worek osierdziowy i rozpocząć aspirację gromadzącej się krwi oraz odwrócić działanie heparyny, podając siarczan protaminy. Następnie, jeśli prowadnik pozostaje w świetle naczynia, należy w miejsce uszkodzenia implantować stentgraft wieńcowy. Zazwyczaj udaje się w ten sposób skutecznie opanować krwawienie. W przypadku perforacji drobnego naczynia z dużym krwawieniem do worka osierdziowego skuteczna bywa przedłużona inflacja cewnika balonowego powyżej perforacji lub zamknięcie naczynia za pomocą różnych materiałów embolizacyjnych. Rzadko, gdy krwawienia nie można opanować w pracowni, konieczna jest interwencja kardiochirurgiczna. Ryciny 3 i 4 przedstawiają przykłady perforacji tętnicy wieńcowej, odpowiednio typu II i III wg klasyfikacji Ellisa.
Jednym z rzadkich powikłań zabiegów PCI o nie do końca wyjaśnionej etiologii jest udar mózgu. Według danych gromadzonych w amerykańskiej bazie NCDR (National Cardiovascular Data Registry) dochodzi do niego w około 0,2% przypadków zabiegów PCI [13]. Według bazy AISN udar mózgu w czasie zabiegu zdarza się u 0,03% pacjentów, najczęściej u leczonych z powodu ostrego zawału mięśnia sercowego. Do uznanych czynników ryzyka należą tu: stwierdzona wcześniej choroba naczyniowo-mózgowa, podeszły wiek, PCI w zawale mięśnia sercowego, zwłaszcza po wcześniejszym leczeniu fibrynolitycznym, stosowanie kontrapulsacji wewnątrzaortalnej, a także płeć żeńska. W większości przypadków udar ma etiologię niedokrwienną. Wystąpienie tego powikłania znacznie zwiększa ryzyko zgonu, do którego dochodzi nawet u jednej czwartej pacjentów z udarem mózgu [13].
Powikłania krwotoczne
W miarę rozwoju technik przezskórnych interwencji wieńcowych zmianom ulegała farmakoterapia wspomagająca zabiegi PCI. Wprowadzenie nowoczesnych leków przeciwpłytkowych, takich jak doustni antagoniści receptora P2Y12 oraz stosowane dożylnie inhibitory receptora GP IIb/IIIa, zdecydowanie poprawiło bezpieczeństwo zabiegów przez istotne zmniejszenie powikłań niedokrwiennych, ale jednocześnie zwiększyło się ryzyko powikłań krwotocznych. Niestety jest coraz więcej dowodów na to, że wystąpienie powikłań krwotocznych, nawet takich, w których utrata krwi nie prowadzi do zapaści hemodynamicznej, jest niezależnym czynnikiem ryzyka zgonu i zawału mięśnia sercowego [14]. Przyczyną może być aktywacja układu krzepnięcia w odpowiedzi na krwawienie, odstawienie leków przeciwpłytkowych, a także samo przetoczenie krwi [15]. Mechanizm niekorzystnego działania preparatów krwi nie jest do końca wyjaśniony, ale bierze się pod uwagę aktywację płytek krwi i osoczowego układu krzepnięcia, zamykanie drobnych naczyń mikrokrążenia przez dysfunkcyjne, niezdolne do odkształcania erytrocyty, a także malejącą z czasem przechowywania preparatu zdolność hemoglobiny do transportu tlenu i oddawania go tkankom.
Do podstawowych czynników ryzyka wystąpienia powikłań krwotocznych należą: zabiegi PCI u pacjentów z ostrym zespołem wieńcowym, podeszły wiek, płeć żeńska, otyłość lub mała masa ciała, współistnienie choroby wrzodowej żołądka, cukrzycy, nadciśnienia tętniczego, niewydolności nerek, niedokrwistości, małopłytkowości, stosowanie intensywnego leczenia przeciwzakrzepowego w czasie zabiegu (szczególnie inhibitorów GP IIb/IIIa), stosowanie dużych koszulek naczyniowych, kontrapulsacji wewnątrzaortalnej i inne. Duże znaczenie ma niewłaściwe nakłucie tętnicy udowej. Najczęściej jest to nakłucie zbyt niskie, poniżej podziału na tętnicę głęboką i powierzchowną. Wykazaliśmy, że nakłucie udowe wykonane pod kontrolą fluoroskopii zmniejsza ryzyko wystąpienia powikłań krwotocznych [16]. Ostatnio coraz częściej stosuje się dostęp przez tętnicę promieniową, co także przyczyniło się do istotnego zmniejszenia ryzyka wystąpienia krwawień [17].
Do podstawowych sposobów zapobiegania powikłaniom krwotocznym należy przede wszystkim właściwy dobór terapii przeciwzakrzepowej w okresie okołozabiegowym (np. zmniejszenie dawki heparyny u pacjentów otrzymujących inhibitory GP IIb/IIIa, dostosowywanie dawek leków w zależności od czynności nerek, podawanie biwalirudyny zamiast heparyny i inne), monitorowanie czasu krzepnięcia (ACT, APTT) u pacjentów dużego ryzyka, właściwe nakłucie tętnicy udowej z unikaniem stosowania dużych koszulek naczyniowych, wykorzystywanie dostępu przez tętnicę promieniową, podawanie inhibitorów pompy protonowej u chorych z dużym ryzykiem krwawienia z przewodu pokarmowego. Powinno unikać się pochopnego przetaczania preparatów krwi. Nie należy się kierować wyłącznie stężeniem hemoglobiny, ograniczając transfuzje do pacjentów w ciężkim stanie ogólnym spowodowanym krwawieniem, poddawanych rozległym naprawczym zabiegom chirurgicznym (np. z powodu krwawienia pozaotrzewnowego). U pacjentów, u których wyjściowo stwierdzono niedokrwistość (niezależny czynnik ryzyka wystąpienia powikłań krwotocznych), zabieg PCI należy w miarę możliwości odroczyć do momentu postawienia diagnozy i wyrównania stężenia hemoglobiny.
Pokontrastowe ostre uszkodzenie nerek
Częstość występowania CIAKI zależy od przyjętej definicji. Najczęściej powikłanie to rozpoznaje się, gdy po zabiegu dochodzi do nagłego pogorszenia funkcji nerek z bezwzględnym przyrostem stężenia kreatyniny w surowicy krwi o 0,5 mg/dl lub jego wzrostem o 25% [18]. Przy takiej definicji CIAKI powikłanie to można rozpoznać u kilku do kilkunastu procent pacjentów po zabiegach PCI. Stężenie kreatyniny zazwyczaj zwiększa się po 24 godzinach od ekspozycji na kontrast, a szczyt osiąga po kilku dniach, gdy pacjent jest już w domu, co sprawia dodatkowy kłopot w rozpoznawaniu tego powikłania. Niestety, mamy wiele dowodów, że wystąpienie CIAKI niezależnie zwiększa ryzyko zgonu pacjentów [19]. Do uznanych czynników ryzyka należą tu: podeszły wiek, cukrzyca, przewlekła choroba nerek, niewydolność serca i stosowanie dużych objętości kontrastów, zwłaszcza wysokoosmolarnych. Obecnie uznanym sposobem zapobiegania CIAKI jest stosowanie kontrastów nisko- i izoosmolarnych, ograniczanie ich objętości oraz odpowiednie nawodnienie pacjenta przed zabiegiem i po nim. W tym celu najlepiej przetaczać dożylnie krystaloidy (np. sól fizjologiczną) w ilości 1-1,5 ml/kg/h przez 3-12 godzin przed zabiegiem i przez 6-24 godzin po zabiegu [20]. Należy też pamiętać o odstawieniu leków nefrotoksycznych przed zabiegami PCI. Wiele prac wykazało korzystną rolę niektórych substancji w zapobieganiu CIAKI (np. N-acetylocysteiny czy dwuwęglanu sodu), jednak żadna z nich nie zyskała powszechnego uznania i nie jest zalecana w najnowszych wytycznych PCI [8].
Powikłania związane z działaniem promieniowania jonizującego
Promieniowanie jonizujące wywiera szkodliwe efekty biologiczne na organizm ludzki, a jego skutki zależą od dawki. Działania stochastyczne to wywoływanie zmian genetycznych i nowotworowych. Działania niestochastyczne (deterministyczne) to zmiany w tkankach lub narządach wynikające z bezpośredniego uszkodzenia komórek. W czasie zabiegów PCI, ze względu na bliskość źródła promieniowania, najbardziej narażonym miejscem jest skóra pleców pacjenta. Aby zminimalizować ryzyko uszkodzenia, należy ograniczać dawkę promieniowania (odpowiednia odległość źródła i wzmacniacza obrazu od pacjenta, kolimacja, dobór projekcji, zmniejszenie liczby nagrań) oraz często zmieniać projekcje (unikanie wielokrotnej ekspozycji tego samego fragmentu skóry) [21]. W Polsce istnieje obowiązek rejestracji dawki pochłoniętej przez pacjenta wyrażonej w grejach (Gy). Przy przekroczeniu sumarycznej dawki na skórę pacjenta 1 Gy istnieje obowiązek umieszczenia tej informacji na karcie informacyjnej przy wypisie ze szpitala. Po przekroczeniu sumarycznej dawki 3 Gy mogą wystąpić reakcje skórne. Pojawiają się one zazwyczaj po kilku tygodniach, dlatego należy pacjenta skierować na kontrolę do dermatologa po trzech tygodniach od zabiegu. W zależności od dawki objawy skórne to: rumień, czasowa lub trwała utrata włosów, atrofia, teleangiektazje i wreszcie martwica skóry. W Polsce, podobnie jak w całej Unii Europejskiej, obowiązują normy prawne ochrony radiologicznej (Dyrektywa Rady 96/29/EURATOM z 13 maja 1996 roku, Dyrektywa Rady 97/43/EURATOM z 30 czerwca 1997 roku, Rozporządzenie Ministra Zdrowia z 25 sierpnia 2005 roku) oraz w sprawie warunków bezpiecznego stosowania promieniowania jonizującego dla wszystkich rodzajów ekspozycji medycznej (DzU Nr 194, poz. 1625 oraz Rozporządzenie Ministra Zdrowia z 2 lutego 2007 roku) i w sprawie szczegółowych wymagań dotyczących formy i treści wzorcowych i roboczych medycznych procedur radiologicznych (DzU z 14 lutego 2007 roku).
Podsumowanie
Postęp w kardiologii interwencyjnej w ostatnich latach doprowadził do znacznego rozszerzenia możliwości leczenia coraz bardziej złożonych zmian u coraz starszych, trudniejszych pacjentów, nie zmniejszając przy tym bezpieczeństwa wykonywanych zabiegów. Wręcz przeciwnie, częstość interwencji chirurgicznych ratujących życie pacjenta zmniejszyła się z kilku procent w latach 80. XX wieku do mniej niż promila, występowanie ostrej i podostrej zakrzepicy w stencie spadło z blisko 20% w latach 90. do poniżej 1%, a śmiertelność szpitalna pacjentów z ostrym zawałem mięśnia sercowego – z kilkunastu procent w czasach fibrynolizy do 3-4% przy leczeniu interwencyjnym. W zabiegach elektywnych, mimo większego obciążenia pacjentów związanego z wiekiem i chorobami współistniejącymi, zgony zdarzają się nadal rzadko. Według amerykańskiej bazy NCDR w latach 2004-2007 śmiertelność szpitalna wynosiła 0,6%, a z danych AISN wynika, że zgon w pracowni przy planowym zabiegu PCI wystąpił w ubiegłym roku u 0,1% leczonych.