Choroby genetyczne OUN przebiegające z gromadzeniem metali: żelaza, manganu i miedzi – schematy diagnostyczno-lecznicze
dr n. med. Karolina Dzieżyc1
dr hab. n. med. Tomasz Litwin1
prof. dr hab. n. med. Anna Członkowska1,2
Gromadzenie się metali w ośrodkowym układzie nerwowym prowadzi do ciężkich i często nieodwracalnych uszkodzeń. Toksyczny wpływ metali na ten układ może wynikać z egzogennego zatrucia związkami zawierającymi metale (np. efedron), jak również mieć podłoże genetyczne. Najlepiej poznanymi genetycznymi chorobami neurologicznymi są zespoły spowodowane gromadzeniem się żelaza, manganu i miedzi.
Wprowadzenie
W artykule omówiono trzy grupy chorób. Pierwszą jest neurodegeneracja z gromadzeniem żelaza (NBIA – neurodegeneration with brain iron accumulation), obejmująca jednostki chorobowe z różnorodnymi zaburzeniami neurologicznymi. Do grupy drugiej należy zespół chorobowy związany z gromadzeniem manganu, charakteryzujący się uszkodzeniem wątroby, policytemią oraz uogólnioną dystonią. Wreszcie choroba Wilsona, związana z zaburzeniem metabolizmu miedzi, cechuje się uszkodzeniem wątroby oraz objawami neuropsychiatrycznymi.
Neurodegeneracja z gromadzeniem żelaza
NBIA to grupa chorób polegających na odkładaniu się żelaza głównie w jądrach podstawy. W NBIA występują różnorodne objawy neurologiczne, a w przypadku niektórych zespołów – także ogólnoustrojowe.1-5 Pierwsze objawy choroby mogą pojawić się w okresie od dzieciństwa do 6 dekady życia.1-5 W diagnostyce NBIA istotny jest rezonans magnetyczny (MR – magnetic resonance) głowy, w którym w sekwencji T2 stwierdza się hipodensyjne zmiany w jądrach podkorowych związane z obecnością żelaza. Dużą rolę w potwierdzeniu rozpoznania konkretnego zespołu odgrywa badanie genetyczne. W aceruloplazminemii oraz neuroferrytynopatii pierwotnie dochodzi do zaburzeń metabolizmu żelaza. W pozostałych zespołach patogeneza jest niejasna – związek z żelazem i uszkodzeniami albo nie został wytłumaczony, albo nieznany jest defekt genetyczny, a stwierdza się odkładanie tego metalu.1-5
Poniżej omówiono najczęściej występujące zespoły NBIA. Pozostałe, bardzo rzadkie jednostki chorobowe związane z gromadzeniem żelaza, m.in. chorobę Kufor-Rakeb, aceruloplazminemię, neurodegenerację związaną z mutacją genu dla 2-hydroksylazy kwasów tłuszczowych (FAHN – fatty acid hydroxylase-associated neurodegeneration), neuroferrytynopatię i BPAN (beta-propeller protein-associated neurodegeneration), przedstawiono w tabeli 1.1-8
Neurozwyrodnienie związane z kinazą pantotenianu
Neurozwyrodnienie związane z kinazą pantotenianu (PKAN – pantothenate kinase-associated neurodegeneration) to najczęściej występujący zespół (1-3/1 mln przypadków).1-4 Jego przyczyną jest mutacja w genie kodującym kinazę pantotenianu 2, która bierze udział w biosyntezie koenzymu A, niezbędnego do metabolizmu kwasów tłuszczowych. Skutkuje to zaburzeniami procesów β-oksydacji kwasów tłuszczowych i odkładaniem się L-cysteiny chelatującej żelazo.1-4
W postaci klasycznej PKAN pierwsze objawy występują przed 6 r.ż. Dominuje sztywność mięśniowa, stopniowo rozwija się uogólniona dystonia. Ponadto stwierdza się zwyrodnienie barwnikowe siatkówki oraz obecność akantocytów w rozmazie krwi. W postaci późnodziecięcej objawy pojawiają się w 2 dekadzie życia i są mniej nasilone niż w postaci klasycznej. Często występują zaburzenia zachowania. Choroba o początku objawów w wieku dorosłym cechuje się przedłużonym przebiegiem.1-4
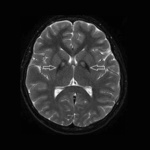
Rycina 1. MR głowy, obrazy T2-zależne. Objaw oka tygrysa u pacjenta z PKAN (zmiany hipodensyjne w obrębie gałek bladych związane z gromadzeniem się żelaza oraz centralna hiperdensja)
Charakterystyczne dla PKAN są zmiany w MR głowy. Stwierdzenie objawu oka tygrysa (hipodensja w obrębie gałek bladych w sekwencji T2 związana z gromadzeniem żelaza oraz centralną hipertensją) może być bardzo pomocne w diagnostyce choroby (ryc. 1). Rozmaz krwi obwodowej wykazuje obecność akantocytów. Istotną rolę w diagnostyce odgrywa także badanie genetyczne, które może potwierdzić rozpoznanie.1-4
W leczeniu choroby wykorzystuje się deferypron, lek chelatujący żelazo. Wyniki terapii nie zostały w pełni potwierdzone badaniami klinicznymi – dostępne są tylko obserwacje przypadków.9,10 W przypadku PKAN stosuje się obecnie leczenie objawowe. Chorym podaje się lewodopę, toksynę botulinową, baklofen i benzodiazepiny. Podejmowane są również próby leczenia głęboką stymulacją mózgu (DBS – deep brain stimulation), z różnymi efektami.1-4
Neurodegeneracja związana z PLA2G6
Neurodegeneracja związana z PLA2G6 (PLAN – PLA2G6-associated neurodegeneration) to drugi co do częstości występowania zespół NBIA. Jego przyczyną jest mutacja w genie kodującym białko PLA2G6, znajdującym się na chromosomie 22. PLA2G6 to fosfolipaza zależna od wapnia, zaangażowana w metabolizm wolnych kwasów tłuszczowych.1-4 W PLAN dochodzi do zaburzenia przepuszczalności błon komórkowych.