Strukturalne choroby serca i kardiomiopatie
Okołozastawkowe defekty strukturalne u chorych po chirurgicznej implantacji zastawek serca
Grzegorz Smolka,1 Piotr Pysz,2 Romuald Twardowski2
Wprowadzenie
Częstość występowania uszkodzeń w obrębie struktur sąsiadujących z implantowaną chirurgicznie zastawką serca jest bardzo mała, co wynika przede wszystkim z ciągle doskonalonych technik operacyjnych i ogromnego doświadczenia zespołów kardiochirurgicznych. Rozwój kardiochirurgii oznacza jednak m.in. objęcie tym rodzajem leczenia coraz starszych osób, a więc także takich, u których prawdopodobieństwo znacznej degeneracji tkanek w operowanej okolicy jest duże, podobnie jak ryzyko wystąpienia strukturalnych powikłań pooperacyjnych. Znaczna część tego rodzaju nabytych uszkodzeń struktur serca poważnie obciąża rokowanie, co uzasadnia przedstawienie ich charakterystyki w niniejszym artykule.
Przecieki okołozastawkowe
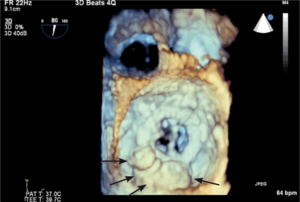
Rycina 1. TEE 3D. Wynik przezskórnego zamknięcia przecieku okołozastawkowego przy protezie uchylno-dyskowej.
Przecieki okołozastawkowe (paravalvular leak, PVL) występują u chorych po implantacji sztucznej zastawki serca, zarówno chirurgicznej, jak i metodą przezskórną lub przezkoniuszkową. W przypadku chirurgicznie implantowanych zastawek są one powikłaniem infekcyjnego zapalenia wsierdzia lub skutkiem poluzowania lub wyprucia fragmentu szwu chirurgicznego albo konsekwencją znacznych zmian typu włóknistego i kalcyfikacji w natywnym pierścieniu zastawkowym, utrudniających prawidłowy kontakt między nim a pierścieniem sztucznej zastawki. Częstość występowania wszystkich (w tym również niewielkich) PVL ocenianych w przezprzełykowym badaniu echokardiograficznym szacuje się na kilkanaście procent u osób po implantacji zastawki aortalnej (aortic valve replacement, AVR) i nieco ponad 20% po implantacji zastawki w pozycji mitralnej (mitral valve replacement, MVR) [1-3]. Według piśmiennictwa kliniczne objawy przecieku okołozastawkowego (niewydolność serca, hemoliza i zwiększone ryzyko wystąpienia infekcyjnego zapalenia wsierdzia) występują u około 1-5% pacjentów po AVR lub MVR [4], przy czym częściej jawne klinicznie są przecieki okołomitralne [5]. Wśród pacjentów z PVL i hemolizą wewnątrznaczyniową należy rozróżnić tych, u których rozpad erytrocytów jest na tyle nasilony, że doprowadza do klinicznie jawnej niedokrwistości, oraz takich, u których przy granicznie małych liczbie czerwonych krwinek i stężeniu hemoglobiny hemolizę wykazać można istotnie zwiększonymi aktywnością LDH, stężeniem bilirubiny pośredniej i haptoglobiny lub zwiększoną liczbą retikulocytów. Diagnostyka obrazowa przecieków okołozastawkowych została szczegółowo omówiona w innych artykułach [6,7]. Leczenie chirurgiczne jest leczeniem z wyboru przy jednoczesnej dysfunkcji zastawki, planowanym jednoczasowym CABG, niestabilności protezy oraz infekcyjnym zapaleniu wsierdzia. W jednej z większych analiz [8] porównujących chorych z PVL leczonych zachowawczo i chirurgicznie wyraźnie udokumentowano korzyść z leczenia zabiegowego (zmniejszenie śmiertelności całkowitej w badanej populacji z 26 do 12%). Alternatywą leczenia chirurgicznego jest przezskórna implantacja zatyczki do kanału przecieku [9]. Wykorzystuje się w tym celu urządzenia dedykowane do zamykania innego typu przecieków wewnątrzsercowych i nieprawidłowych połączeń naczyniowych, jak okludery do zaopatrywania ubytków przegrody międzykomorowej (ventricular septal defect, VSD) czy przetrwałego przewodu tętniczego (patent ductus arteriosus, PDA) lub korki naczyniowe typu Amplatzer vascular plug (AVP, St. Jude Medical). W ośrodku autorów najczęściej wykorzystuje się podczas tych zabiegów korki naczyniowe typu AVP III. Charakteryzują się one spłaszczonym kształtem, co ułatwia ich dopasowanie do zwykle szczelinowatego kształtu przecieku okołozastawkowego. W przypadku przecieków okołomitralnych, szczególnie dostępnych od strony lewego przedsionka lub o znacznych rozmiarach, korzystne może być dojście od strony koniuszka lewej komory serca [10]. Często w zabiegach tych wykorzystuje się więcej niż jedną zatyczkę (ryc. 1).
Tętniaki rzekome
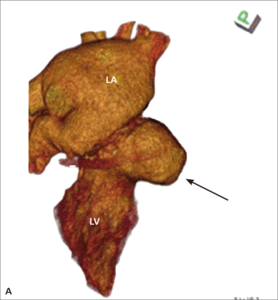
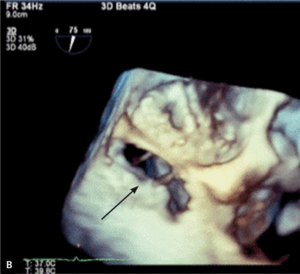
Rycina 2. Tętniak rzekomy lewej komory (strzałki) u pacjentki po implantacji protezy 2-dyskowej w pozycję mitralną.
Tętniaki rzekome lewej komory serca (left ventricular pseudoaneurysm, LVPA) są rzadkim, lecz bardzo poważnym powikłaniem zarówno zawału mięśnia sercowego, jak i leczenia operacyjnego. W tym drugim przypadku szczególnie wymiana zastawki mitralnej jest kojarzona ze zwiększoną częstością występowania LVPA. Pierwszy raz powikłanie to opisano w 1967 r. [11]. Częstość występowania tętniaków rzekomych u chorych po MVR szacuje się na 0,8-2% [12, 13]. Mają inną lokalizację niż tętniaki pozawałowe – LVPA po wymianie zastawki mitralnej stwierdza się zwykle w okolicy podpierścieniowej [14]. Do pęknięcia ściany lewej komory dojść może jeszcze na sali operacyjnej (tzw. wczesne pęknięcie), po kilku dniach (pęknięcie opóźnione), jak i później – po tygodniach lub miesiącach od operacji. Szacuje się, że późne pęknięcia odpowiadają za powstawanie około 10% wszystkich tętniaków rzekomych lewej komory serca po MVR [15]. Powstawaniu wczesnych LVPA sprzyja współistnienie trzech czynników: osłabiona struktura mięśniówki, agresywne manipulacje chirurgiczne i występowanie znacznych sił prowokujących przerwanie ciągłości mięśnia [16]. Jeżeli jama tętniaka jest wystarczająco duża (ryc. 2A, B), to mogą rozwinąć się objawy kliniczne zbliżone do obserwowanych w niedomykalności zastawki mitralnej. Rokowanie jest jednak określone przede wszystkim przez naturę tętniaka. Ograniczona jedynie osierdziem jama LVPA z dużym prawdopodobieństwem (szacowanym na około 45%) może pęknąć [17], co może mieć fatalne konsekwencje. Tętniaka rzekomego różnicować należy z przeciekiem okołozastawkowym, dysfunkcją protezy i przeciekiem między lewą komorą serca a zatoką wieńcową. Leczeniem z wyboru jest naprawa chirurgiczna. W zależności od lokalizacji tętniaka [18] może być ona wykonana z dostępu przez lewy przedsionek (typ 1 LVPA w tylnej części bruzdy przedsionkowo-komorowej) lub od strony epikardium, bez otwierania jam serca (tętniak ograniczony do miokardium [typ 2], powstały wskutek pęknięcia ściany tylnej u podstawy mięśnia brodawkowatego, oraz typ 3 LVPA, do powstania którego dochodzi w wyniku pęknięcia w lokalizacji między typem 1 i 2, czasami możliwy jest dostęp z lewej torakotomii). W przypadku tętniaka rzekomego o wąskiej szyi możliwe jest zamknięcie przezskórne [19].
Możliwe jest również występowanie tętniaków rzekomych po przerwaniu ciągłości ściany aorty na komorowym brzegu protezy zastawki aorty. Częstość tego zjawiska szacuje się na <1%, wzrasta ona jednak do około 4% u pacjentów, u których przeprowadza się jednoczesną wymianę aorty wstępującej na homograft [20]. Zwykle chorzy z tym powikłaniem nie mają objawów, choć możliwe jest wystąpienie niewydolności serca w związku ze zmniejszeniem objętości wyrzutowej lub przeciążeniem objętościowym lewej komory [20]. Wielokrotnie do wstępnej oceny tętniaka wystarcza echokardiografia przezklatkowa, jednak dopiero wielorzędowa tomografia komputerowa umożliwia dokładną ocenę całego bliskiego sąsiedztwa protezy zastawkowej [21].
Najpoważniejsze następstwa tego powikłania obejmują: pęknięcie lub ucisk aorty wstępującej (albo jej protezy) oraz miejscowe zakażenie [22]. Leczeniem z wyboru jest ponowna operacja, choć przy korzystnej anatomii możliwe jest również zamknięcie wrót tętniaka przezskórnie implantowanym okluderem [23].
Defekt Gerbode
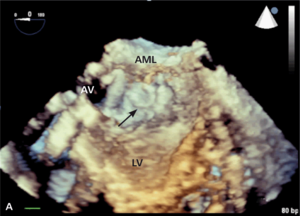
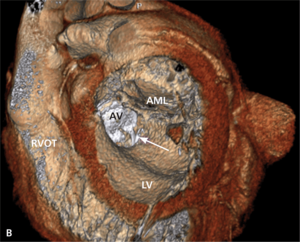
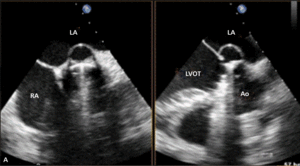
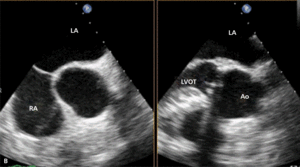
Umiejscowienie zastawki trójdzielnej ok. 15 mm poniżej zastawki mitralnej stwarza warunki anatomiczne do wytworzenia bezpośredniego przecieku między lewą komorą serca a prawym przedsionkiem. Defekt został opisany po raz pierwszy pod koniec XIX w., nazwany jednak został defektem Gerbode od nazwiska chirurga, który pierwszy opisał grupę pacjentów, u których wykonano operacyjną korektę tej wady serca [24]. Wówczas już od wielu lat znana była również nabyta jej postać. Do wytworzenia przecieku typu Gerbode może dojść zarówno po operacji kardiochirurgicznej, jak i wskutek urazu, zawału mięśnia sercowego czy zapalenia wsierdzia [25]. Jako powikłanie chirurgiczne ubytek ten opisywano najczęściej po wymianie zastawki aortalnej lub mitralnej. Częstość jego występowania jest trudna do ustalenia ze względu na niewiele usystematyzowanych doniesień na ten temat z udziałem większej liczby chorych poddawanych zabiegom kardiochirurgicznym.
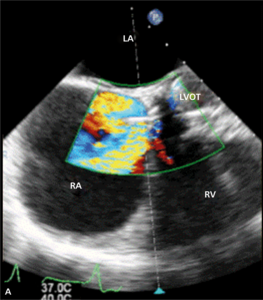
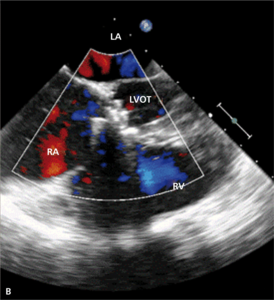
Rycina 4. Wynik przezskórnego leczenia defektu Gerbode w trójwymiarowej echokardiografii przezprzełykowej [A], w 64-rzędowej tomografii komputerowej [B].
O ile wrodzony defekt Gerbode może przebiegać z rozszczepem zastawki trójdzielnej, a ubytek przegrody może być zlokalizowany zarówno nad, jak i pod zastawką trójdzielną, o tyle w opisanych przypadkach nabytej komunikacji między lewą komorą a prawym przedsionkiem zastawka trójdzielna zwykle zbudowana jest prawidłowo. Jeżeli dochodziło do jej równoczesnego uszkodzenia, prawie zawsze wskutek szerzenia się destrukcji tkanek powodowanej bakteryjnym zapaleniem wsierdzia. Opisano również możliwość wystąpienia wady przeciekowej o charakterze tzw. lustrzanego odbicia – połączenia między prawą komorą a lewym przedsionkiem [26].
Symptomatologia i przebieg kliniczny defektu typu Gerbode zbliżone są do obserwowanych u chorych z ubytkiem w przegrodzie międzykomorowej (VSD). Występuje zastój w krążeniu płucnym, a w przypadku nagłego powstania istotnego hemodynamicznie przecieku objawy mogą sugerować ostrą tamponadę serca [27].
W badaniu echokardiograficznym może dojść do omyłkowej interpretacji strumienia przecieku do prawego przedsionka jako fali zwrotnej przez zastawkę trójdzielną, a w konsekwencji do rozpoznania ciężkiego nadciśnienia płucnego [28]. Pomocą we właściwej interpretacji uzyskanego obrazu może być echokardiografia trójwymiarowa czasu rzeczywistego [29].
Leczenie zabiegowe nabytej wady typu Gerbode to przede wszystkim ponowny zabieg kardiochirurgiczny. Szacowana na podstawie danych sprzed kilkudziesięciu lat śmiertelność okołozabiegowa wynosi około 16% [25]. Gdy nie ma aktywnego zapalenia wsierdzia i przy współistnieniu korzystnych warunków anatomicznych możliwe jest również przezskórne zamknięcie ubytku. Zastosowanie znalazły tutaj zapinki do mięśniowego VSD [30], ubytku w przegrodzie międzyprzedsionkowej (atrial septal defect, ASD) [31] czy PDA [32]. W ośrodku autorów do zamknięcia tego typu ubytku u chorego po AVR (zastawka Sorin Pericarbon) użyto zatyczki dedykowanej do okołobłoniastego VSD (perimembranous VSC, pmVSD), uzyskując pełne zamknięcie ubytku (ryc. 3, 4). Podobnie jak w przypadku innych implantacji zatyczek w okolicę mechanicznej zastawki serca, podstawowym problemem jest taki dobór urządzenia, aby zminimalizować prawdopodobieństwo zablokowania dysków zastawki przy jednocześnie możliwie całkowitym wypełnieniu ubytku.