Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Zauważono natomiast znamienną statystycznie różnicę w powtórzeniach regionu CAG genu receptora androgenowego u zdrowych mężczyzn i u mężczyzn z trądzikiem. Średnia liczba powtórzeń tego regionu wynosiła 22,07 u mężczyzn z grupy kontrolnej i 20,61 u mężczyzn z trądzikiem. Różnica ta nie dotyczyła kobiet. Rezultaty sugerowały możliwość wykorzystania polimorfizmu powtórzeń regionu CAG genu receptora androgenowego, jako markera trądziku u mężczyzn.[4]
Zwrócono także uwagę na rolę polimorfizmu genu TNF-α w patogenezie trądziku. Podwyższony poziom TNF-α i IL-1 α jest jednym z elementów inicjujących reakcję zapalną i immunologiczną w acne po aktywacji receptora TLR2. Loci TNF-α znajduje się na wysoce polimorficznym regionie chromosomu 6p21.3. Obecnie znamy pięć miejsc polimorficznych dla genu TNF-α. Udowodniono, że nie wszystkie lokalizacje są związane ze zwiększoną częstością występowania trądziku. Genotypy TNF-α - 1031T>C, - 863C>A, - 238G>A nie były związane z acne vulgaris, natomiast genotyp TNF-α - 857C>T – tak.[7]
Czynniki środowiskowe
Warunki klimatyczne uważa się za jeden z czynników wpływających na stan zmian skórnych u chorych z trądzikiem, bowiem u 60 proc. obserwowano poprawę w okresie miesięcy letnich i wiosennych. Wyjątek pod tym względem stanowi trądzik wiosenny (acne Mallorca), w którym zmiany skórne pojawiają się wiosną i latem. Trądzik pospolity występuje częściej w obszarach zurbanizowanych, co może być związane z zanieczyszczeniem środowiska.
Odnotowano również większą częstość zachorowań w obszarach o klimacie tropikalnym i subtropikalnym, określanych jako tzw. trądzik tropikalny.[1]
Udział diety w etiologii trądziku wywołuje kontrowersje. Żywność insulinotropowa, zwłaszcza mleko i węglowodany o wysokim indeksie glikemicznym, oraz palenie papierosów wpływają na zmiany poziomu czynnika wzrostu, podobnie jak w okresie dojrzewania. Czynniki wzrostu aktywowane przez żywność pobudzają fosfoinozytydo-3-kinazę onkogenów, aktywują ścieżki sygnałowe, przez wzrost ilości receptorów dla androgenów, oraz uruchamiają zależne od Fox01 geny pobudzające proliferację keratynocytów i lipogenezę sebocytów [14].
Reakcja zapalna, cytokiny, mitogeny
Rola cytokin w patogenezie trądziku jest nie do końca poznana. Metodami immunohistochemicznymi w obrębie gruczołów łojowych wykazano ekspresję IL-1 α i β. W hodowlach gruczołów łojowych IL-1 α nasilała rogowacenie ujść przewodu wyprowadzającego gruczołów łojowych oraz nasilała produkcję naczyniowo-śródbłonkowego czynnika wzrostu (VEGF). W zaskórnikach u osób z trądzikiem stwierdzono wysoki poziom IL-1 α.
W etiologii trądziku rolę odgrywają wymieniane wcześniej receptory TLR2. Pobudzenie TLR2 przez Propionibacterium acnes powoduje wzrost stężenia IL-8 i IL-12. Makrofagi otaczające jednostkę włosowo-łojową z receptorami typu TLR2 były histologicznie opisywane w bioptatach pacjentów z trądzikiem. Retinoidy stosowane zewnętrznie (adapalen, kwas całkowicie trans-retinowy) powodują spadek ekspresji TLR2 na monocytach (kwas całkowicie trans-retinowy) oraz keratynocytach (adapalen).
TLR2 (Toll-like Receptor-2) znajdujący się w monocytach, identyfikuje składniki ścian bakterii Gram-dodatnich, m.in. Propionibacterium acnes. Aktywacja TLR2 w monocytach nasila produkcję TNF-α, IL-1 β, IL-8 i IL-12, co przyciąga do mieszka neutrofile i limfocyty. Podobne obserwacje dotyczyły inkubacji świeżo izolowanych obwodowych mononuklearów z supernatantem 72-godzinnych kultur Propionibacterium acnes. Uważa się więc, że to cytokiny prozapalne (badanie dotyczyło: IFN-γ, IL-8 i IL-12 p40), których poziomy wzrastają u pacjentów z acne pod wpływem Propionibacterium acnes, odpowiedzialne są za powstawanie wykwitów zapalnych, a nie, jak dotąd uważano, sama infekcja.
Badania dotyczące IL-1 α w trądziku dotyczyły głównie modeli komórkowych jednostki włosowo-łojowej. In vivo również zwracano uwagę na zwiększoną aktywność IL-1 α w mieszkach włosowych i krwi obowodwej osób ze zmianami typu acne. Już w postaciach subklinicznych obserwowano zwiększoną aktywność tej prozapalnej cytokiny w okolicy mieszka włosowego. Keratynocyty syntezują również antagonistów receptora IL-1 (IL-1ra), co ogranicza działanie IL-1 oraz przechowują preformowaną IL-1 α, a także produkują IL-1 β. IL-1 α jest pierwszym sygnałem stymulującym keratynocyty do produkcji keratyn K16, K6, K17, które odpowiadają m.in. za hiperkeratozę w obrębie mieszka włosowego. Wzrost poziomu IL-1 α powoduje także najprawdopodobniej zaburzenia regulacji czynników przylegania śródbłonkowego: ICAM-1, E-selektyny, VCAM-1 oraz migracji limfocytów T (CD4) i makrofagów we wczesnych stadiach komedogenezy. [1,2,3]
Terapia trądziku została zrewolucjonizowana w latach 80. XX wieku, kiedy po raz pierwszy zastosowano pochodne witaminy A w leczeniu ogólnym.
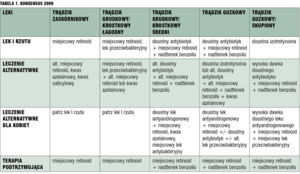
Konsensus z 2009 roku (aktualizacja 2012-2013) dotyczący leczenia trądziku zmienił znacznie podejście do terapii retinoidami: we wszystkich postaciach trądziku (z wyjątkiem kobiet w ciąży) terapia skojarzona, oparta o retinoidy miejscowe lub ogólne (trądzik skupiony), jest leczeniem pierwszego rzutu (tab. 1).
Poniżej przedstawimy przegląd większości metod terapii acne.
Leczenie trądziku
Stosuje się leczenie miejscowe i ogólne.
Leczenie miejscowe trądziku
W leczeniu tym wykorzystuje się środki różnego rodzaju: przeciwłojotokowe, komedolityczne, przeciwbakteryjne oraz przeciwzapalne.[2,4]