Zamówienia złożone w dniach 29.04 - 06.05 zostaną wysłane po 06.05. Aby zrekompensować te niedogodności, zamówienia złożone w tym terminie są objęte Majówkową Darmową Dostawą >
Leczenie przeciwzakrzepowe po rewaskularyzacji chirurgicznej
U pacjentów poddawanych endarterektomii tętnicy szyjnej (CEA – carotid endarterectomy) w badaniach klinicznych i w rejestrach z codziennej praktyki wykazano zmniejszenie częstości występowania okołozabiegowych i odległych incydentów niedokrwiennych w przypadku stosowania kwasu acetylosalicylowego. W 30-dniowej obserwacji podawanie niskich dawek kwasu acetylosalicylowego okazało się skuteczniejsze w redukcji odsetka MACE niż stosowanie dawek wysokich. Dodatkowo wyniki badań wskazują, że dodanie drugiego leku przeciwpłytkowego zmniejsza ryzyko powikłań neurologicznych w porównaniu ze stosowaniem tylko kwasu acetylosalicylowego u pacjentów z niedawno przebytym TIA/udarem mózgu1,2.
U bezobjawowych pacjentów poddawanych CEA badanie retrospektywne obejmujące 28 683 procedury wykazało, że stosowanie DAPT wiązało się z uzyskaniem 39% redukcji ryzyka zdarzeń neurologicznych w porównaniu z samym kwasem acetylosalicylowym (iloraz szans [OR – odds ratio] 0,61; 95% CI 0,43-0,87), kosztem większego odsetka krwawień wymagających reoperacji (OR 1,71; 95% CI 1,20-2,42)23. Jednak w niedawnej metaanalizie porównującej DAPT (n = 8536) z monoterapią (n = 27 320) podczas CEA wykazano, że stosowanie DAPT nie zmniejszało śmiertelności 30-dniowej, częstości występowania udaru mózgu ani TIA. Zwiększyło natomiast częstość występowania poważnych krwawień (1,27% vs 0,83%; p = 0,0003) i krwiaków szyi (8,19% vs 6,77%; p = 0,001)24.
Pacjenci z chorobą tętnic obwodowych ze współistniejącymi wskazaniami do leczenia przeciwkrzepliwego
U pacjentów z PAD można stwierdzić także inne stany wymagające czasowego lub stałego leczenia przeciwkrzepliwego. Na przykład u chorych z LEAD obserwuje się zwiększone ryzyko migotania przedsionków (AF – atrial fibrillation). AF stwierdza się u ponad 10% pacjentów hospitalizowanych z powodu LEAD – wiąże się ono ze zwiększonym ryzykiem udaru mózgu, amputacji i zgonu. Pacjenci z AF i PAD mają z definicji wynik w skali CHA2DS2-VASc ≥1 pkt i kwalifikują się do przewlekłego leczenia przeciwkrzepliwego1,2.
Porównując rywaroksaban z warfaryną u pacjentów z AF w badaniu ROCKET AF (Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism) zaobserwowano podobne korzyści pod względem pierwszorzędowego punktu końcowego u pacjentów z LEAD, jednak stwierdzono zwiększone ryzyko powikłań krwotocznych w przypadku rywaroksabanu w porównaniu ze stosowaniem warfaryny (HR 1,40; 95% CI 1,06-1,86; p = 0,037)25. W innym badaniu nie stwierdzono natomiast istotnej różnicy w zakresie poważnych krwawień w przypadku stosowania rywaroksabanu w porównaniu z warfaryną u pacjentów z CAD lub LEAD (HR 1,13; 95% CI 0,84-1,52)26. Podobnie zwiększonego ryzyka nie zaobserwowano w przypadku stosowania apiksabanu w porównaniu z warfaryną u pacjentów z LEAD w podgrupie z badania ARISTOTLE (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation) (HR 1,05; 95% CI 0,69-1,58)27. W ogólnokrajowym badaniu kohortowym na Tajwanie stwierdzono mniejszą częstość krwawień po podaniu doustnych leków przeciwkrzepliwych niebędących antagonistami witaminy K (NOAC – non-vitamin K antagonist oral anticoagulants) w porównaniu z warfaryną (HR 0,64; 95% CI 0,50-0,80)28. Wobec braku badań dotyczących pacjentów z AF i PAD NOAC pozostają preferowane w stosunku do warfaryny1,2.
Jednocześnie w przewlekłej fazie choroby nie ma solidnego uzasadnienia dla dodania terapii przeciwpłytkowej do leczenia przeciwkrzepliwego u pacjentów z AF i PAD. Badanie obejmujące 14 199 hospitalizowanych chorych z AF, niewydolnością serca i współistniejącą CAD lub PAD wykazało, że dodanie leku przeciwpłytkowego do warfaryny nie ograniczyło incydentów niedokrwiennych w porównaniu z samą warfaryną, ale zwiększyło ryzyko krwawienia. Podobnie lek przeciwpłytkowy w połączeniu z lekiem przeciwkrzepliwym u pacjentów z AF i CAD nie zmniejszył odsetka MACE, ale zwiększył ryzyko krwawienia29. Eksperci ESC rekomendują zatem unikanie rutynowego dodawania leku przeciwpłytkowego u pacjentów z PAD wymagających pełnej dawki leku przeciwkrzepliwego1,2.
Jednocześnie w przypadku stentowania tętnic obwodowych brakuje dowodów na optymalny schemat leczenia przeciwzakrzepowego. Eksperci ESC rekomendują krótkoterminowe stosowanie 1 leku przeciwpłytkowego u pacjentów otrzymujących lek przeciwkrzepliwy w pełnej dawce. Czas takiego leczenia powinien być jak najkrótszy (1 miesiąc), w zależności od wskazania klinicznego i ryzyka krwawienia; w przypadku wysokiego ryzyka krwawienia należy zastosować najniższą dawkę NOAC zatwierdzoną w zapobieganiu udarowi. Ostatnio przeprowadzona metaanaliza 4 randomizowanych badań klinicznych porównujących połączenie NOAC i klopidogrelu z potrójną terapią antagonistą witaminy K, kwasem acetylosalicylowym i klopidogrelem u pacjentów poddawanych stentowaniu tętnic wieńcowych wykazała, że podwójna terapia zmniejsza ryzyko krwawienia o 34%, chociaż zwiększa ryzyko zakrzepicy w stencie o 59%30. Warto zauważyć, że poważne i/lub klinicznie istotne krwawienia były ponad 3 razy częstsze niż zdarzenia niedokrwienne. Ekstrapolując te dowody na PAD, w przypadku niskiego ryzyka zakrzepicy w stencie eksperci sugerują leczenie pacjentów z AF i poddawanych stentowaniu tętnic obwodowych za pomocą NOAC z klopidogrelem przez 1 miesiąc, z dodaniem kwasu acetylosalicylowego również przez 1 miesiąc (tzw. potrójna terapia) tylko w wybranych przypadkach o najwyższym ryzyku zakrzepicy w stencie (np. wcześniejsza zakrzepica w stencie, zwolniony przepływ na koniec zabiegu). Odwrotnie, jeśli ryzyko krwawienia jest wysokie, należy zastosować sam lek przeciwkrzepliwy1,2.
Podsumowując:
- Gdy wskazane jest stosowanie leku przeciwkrzepliwego w pełnej dawce u pacjentów z PAD, na ogół należy unikać dodawania leczenia przeciwpłytkowego ze względu na ryzyko krwawienia (z wyjątkiem niedawnej przezskórnej rewaskularyzacji).
- Dołączenie leku przeciwpłytkowego do leku przeciwkrzepliwego w pełnej dawce należy rozważyć jedynie u pacjentów z wysokim ryzykiem zakrzepicy, uwzględniając jednocześnie ryzyko krwawienia.
Ryzyko krwawienia u pacjentów z chorobą tętnic obwodowych
Ocena ryzyka krwawienia jest konieczna przed rozpoczęciem leczenia przeciwzakrzepowego. Pacjenci z PAD są na ogół bardziej narażeni na krwawienie w porównaniu z przeciętnymi pacjentami z CAD. Niemniej dane dotyczące ryzyka krwawienia u chorych z PAD są ograniczone. Skale takie jak HAS-BLED charakteryzują się słabą wartością rokowniczą u tych pacjentów. Niedawno zatwierdzono skalę ARC-HBR (Academic Research Consortium for High Bleeding Risk) jako narzędzie przewidywania krwawienia u pacjentów z CAD poddawanych przezskórnym interwencjom wieńcowym, jednak nadal nie została ona zwalidowana u pacjentów z PAD1,2. Tylko w jednym badaniu oceniano wpływ stosowania inhibitorów pompy protonowej w zmniejszaniu krwawienia z przewodu pokarmowego u pacjentów z PAD. W badaniu COMPASS wykazano zmniejszenie ryzyka krwawienia wtórnego do zmian żołądkowo-jelitowych w przypadku stosowania pantoprazolu (HR 0,52; 95% CI 0,28-0,94)31.
Podsumowanie
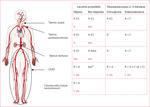
Rycina 1. Podsumowanie optymalnych i alternatywnych strategii przeciwzakrzepowych u pacjentów z chorobą tętnic obwodowych. W nawiasach podano alternatywną opcję leczenia, natomiast na czerwono zaznaczono opcję w przypadku wysokiego ryzyka krwawienia. Na rycinie wykorzystano rysunek Arterial circulation z bazy Servier Medical Art by Servier (https://smart.servier.com/smart_image/artery-42/), udostępniony na licencji Creative Commons Attribution 3.0 Unported License (https://creativecommons.org/licenses/by/3.0/), zmodyfikowany o tekst i oznaczenia graficzne
Pacjenci z PAD są narażeni na wysokie ryzyko zarówno niekorzystnych zdarzeń sercowo-naczyniowych, jak i MALE. Przyczyną zdarzeń niedokrwiennych u tych chorych jest nie tylko aktywacja płytek krwi, lecz także inicjacja i promocja kaskady krzepnięcia, w której kluczową rolę odgrywa czynnik Xa. W ciągu ostatnich kilku lat publikacja licznych badań doprowadziła do znacznego postępu wiedzy na temat leczenia przeciwzakrzepowego u pacjentów z PAD. Obecnie oprócz leków przeciwpłytkowych, w tym nowych inhibitorów receptora P2Y12 (tikagrelor, prasugrel), coraz większe znaczenie ma stosowanie inhibitora czynnika Xa, czyli rywaroksaban w dawce naczyniowej. Podsumowanie rekomendowanych opcji terapeutycznych przedstawiono na rycinie 1.