Nietypowe związki
Łuszczyca i miażdżyca – związek nieprzypadkowy
Dr hab. med. Aneta Szczerkowska-Dobosz
Lek. med. Olivia Komorowska
Choroby układu sercowo-naczyniowego są przewlekłymi schorzeniami rozwijającymi się latami, często bez wyraźnych objawów klinicznych, a ich poważne konsekwencje pojawiają się w zaawansowanych stadiach. Choroby te są najczęstszą przyczyną przedwczesnych zgonów w Polsce.
Miażdżyca – główna przyczyna schorzeń sercowo-naczyniowych – jest obecnie uznawana za chorobę o zapalnej patogenezie, w której mechanizmy immunologiczne współdziałają z czynnikami środowiskowymi, zwiększającymi ryzyko sercowo-naczyniowe.[1] Występowanie chorób sercowo-naczyniowych i spowodowana nimi śmiertelność wiążą się z czynnikami ryzyka miażdżycy. Najważniejsze z nich to zaburzenia gospodarki lipidowej, palenie tytoniu, nadciśnienie tętnicze, cukrzyca, otyłość, wiek, płeć, mała aktywność fizyczna i czynniki psychospołeczne (tab.1). Zgodnie ze współczesną wiedzą, do chorób zwiększających ryzyko sercowo-naczyniowe zalicza się także przewlekłe schorzenia o autoimmunologicznym/immunologicznym podłożu: reumatoidalne zapalenie stawów, toczeń rumieniowaty układowy i łuszczycę.
Koncepcja łuszczycy jako choroby ogólnoustrojowej
Idea ta zrodziła się stosunkowo niedawno. Liczne badania epidemiologiczne, genetyczne i obserwacje kliniczne wykazały, że łuszczyca spełnia kryteria przynależności do grupy przewlekłych, układowych chorób zapalnych. Do schorzeń tych należy ponadto reumatoidalne zapalenie stawów, zesztywniające zapalenie stawów kręgosłupa i nieswoiste zapalenia jelit. W chorobach z kręgu przewlekłych, układowych schorzeń o podłożu zapalnym proces zapalny toczy się nie tylko w układzie kostno-stawowym, skórze czy przewodzie pokarmowym, lecz w sposób istotny wpływa na inne narządy.
Pierwsze, krótkie doniesienie autorstwa Mc Donalda i Calabresiego na temat zależności łuszczycy i chorób sercowo-naczyniowych ukazało się w 1973 roku w formie listu do redakcji prestiżowego czasopisma „The New English Journal of Medicine”.[2] Na podstawie retrospektywnej analizy osób hospitalizowanych z powodów chorób skóry autorzy stwierdzili, że u chorych na łuszczycę, w porównaniu z chorymi cierpiącymi na inne dermatozy, częściej występowały incydenty zatorowe.
Na przestrzeni lat ukazały się liczne doniesienia świadczące o klinicznie istotnym związku łuszczycy z takimi chorobami ogólnoustrojowymi jak nadciśnienie tętnicze krwi, cukrzyca czy otyłość.[3-5] Wykazano m.in., że osoby hospitalizowane z powodu łuszczycy, w porównaniu z osobami leczonymi ambulatoryjnie, obarczone są większym ryzykiem zgonu spowodowanego chorobami układu krążenia. Udowodniono, że śmiertelność związana z chorobami układu krążenia wzrasta wraz z liczbą hospitalizacji z powodu łuszczycy oraz że ciężki przebieg łuszczycy rozpoczynającej się w młodszym wieku predysponuje do zwiększonej śmiertelności z powodu chorób układu krążenia.[6] Te obserwacje potwierdzono na podstawie wyników jednej z największych analiz opartych na brytyjskiej bazie danych Gelfanda i wsp. Badacze wykazali, że osoby chore na łuszczycę obarczone są zwiększonym ryzykiem ostrych zespołów wieńcowych. Co zaskakujące, ryzyko zawału mięśnia sercowego było większe u osób młodych chorujących na ciężką łuszczycę w porównaniu z osobami starszymi cierpiącymi na ciężką postać choroby.[7] W kolejnych latach opublikowano wyniki licznych badań wskazujących, że u chorych występuje zwiększone ryzyko zachorowania także na inne niż choroba wieńcowa, a związane z miażdżycą naczyń, schorzenia układu sercowo-naczyniowego, takie jak udar niedokrwienny mózgu czy choroby naczyń obwodowych. Co więcej, wykazano korelację łuszczycy z parametrami charakteryzującymi występowanie subklinicznej miażdżycy – wskaźnikiem grubości warstwy środkowej i wewnętrznej tętnic szyjnych (IMT, Intima-Media Thickness), wskaźnikiem uwapnienia tętnic wieńcowych (CAC, coronary artery calcification) czy też dysfunkcji śródbłonka ocenianej metodą wazodylatacji tętnicy ramiennej po niedokrwieniu (FMD, flow mediated dilatation).[8,9]
Hipotezy tłumaczące związek łuszczycy z chorobami sercowo-naczyniowymi
Istnieje kilka hipotez tłumaczących ten związek. Korelację tę można tłumaczyć wspólną, zapalną patogenezą łuszczycy i miażdżycy, chorobami współistniejącymi z łuszczycą, czynnikami środowiskowymi towarzyszącymi łuszczycy i następstwami leczenia ogólnego tej choroby.
Zapalna patogeneza łuszczycy i miażdżycy
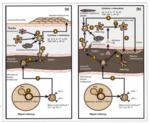
Ryc. 1. Schemat przedstawiający podobieństwo kaskady zjawisk immunologicznych prowadzących do powstania blaszki łuszczycowej w skórze (a) i blaszki miażdżycowej w naczyniu krwionośnym (b).[10]
Przewlekły proces zapalny – charakterystyczna cecha łuszczycy – odgrywa kluczową rolę w wielu, jeśli nie we wszystkich, etapach tworzenia blaszki miażdżycowej. W miażdżycy, która już od kilkunastu lat uznawana jest za chorobę o zapalnej patogenezie, bierze udział podobny profil komórek zapalnych i uwalnianych przez nie prozapalnych cytokin. Zbliżona do łuszczycy kaskada zjawisk immunologicznych odgrywa rolę w patogenezie miażdżycy (ryc. 1).
Proces zapalny w łuszczycy i miażdżycy jest zależny od limfocytów Th1 i Th17. W obu chorobach dochodzi do aktywacji limfocytów T, miejscowej i systemowej ekspresji cząsteczek adhezyjnych i endotelin. Komórki prezentujące antygen (APCs, antygen presenting cells) aktywują limfocyty T, na których dochodzi do ekspresji LFA-1 (lymphocyte function-associated antigen 1, LFA-1), integryny będącej antygenem dla molekuł adhezji. Aktywowane limfocyty T migrują do naczyń krwionośnych, przylegają do komórek śródbłonka naczyń, a następnie przedostają się poza ich światło. Tam wiążą się z makrofagami śródbłonka, komórkami dendrytycznymi i komórkami mięśni gładkich naczyń. Następstwem tych procesów jest wydzielanie licznych cytokin i chemokin tworzących zapalne mikrośrodowisko, sprzyjające powstaniu blaszki łuszczycowej w skórze i blaszki miażdżycowej w naczyniu. Wykazano, że w tworzenie nacieku zapalnego w łuszczycy oraz wczesnych zmian miażdżycowych w ścianach naczyń krwionośnych zaangażowany jest podobny profil cytokin prozapalnych, m.in. IFN-γ, IL-2, IL-6, TNF-α. Ta ostatnia cytokina odgrywa kluczową rolę w patogenezie łuszczycy – pobudza proliferację keratynocytów, chemotaksję neutrofili, wydzielenie cytokin i chemokin przez makrofagi, produkcję wolnych rodników tlenowych, co w konsekwencji prowadzi do dysfunkcji śródbłonka.[10,11]
Innym z mechanizmów łączących patogenezę łuszczycy i miażdżycy jest wzmożone wydzielanie śródbłonkowego czynnika wzrostu naczyń (VEGF, vascular endothelial growth factor) przez keratynocyty.[12] Czynnik ten pobudza komórki śródbłonka, powodując hiperplazję błony wewnętrznej naczyń. Wykazano, że stężenie VEGF koreluje z ciężkością łuszczycy i zwiększoną wartością wskaźnika IMT.[13] Kolejna z hipotez tłumaczy patogenetyczny związek chorób sercowo-naczyniowych z łuszczycą zwiększonym poziomem hemocysteiny u chorych na tę dermatozę.[14] Hiperhomocysteinemia jest uznana za niezależny czynnik ryzyka rozwoju chorób sercowo-naczyniowych, takich jak zawał serca, udar mózgu, a także zgonów z przyczyn sercowo-naczyniowych.
Czynniki środowiskowe towarzyszące łuszczycy zwiększające ryzyko sercowo-naczyniowe
Łuszczyca wywiera znamienny wpływ na psychikę chorych i negatywnie oddziałuje na wiele aspektów jakości życia. O zaskakująco znamiennym wpływie choroby na psychikę świadczy badanie Rapp i wsp., które ujawniło, że jakość życia tych pacjentów jest obniżona w stopniu porównywalnym do jakości życia osób chorujących na ciężkie, przewlekłe schorzenia, takie jak cukrzyca, choroby serca, przewlekła obturacyjna choroba płuc, a nawet choroba nowotworowa.[15] Chorzy na łuszczycę odczuwają wysoki poziom stresu, a choroba powoduje znaczne ograniczenia w ich życiu codziennym i negatywnie wpływa na życie zawodowe, rodzinne oraz intymne. Osoby te unikają aktywności fizycznej i częściej izolują się od otoczenia. Negatywną konsekwencją tych zjawisk jest stosowanie używek – picie alkoholu i palenie papierosów. Niekorzystny wpływ palenia tytoniu na ryzyko sercowo-naczyniowe nie budzi obecnie wątpliwości. Wykazano, że chorzy na łuszczycę palący powyżej 20 papierosów dziennie są dwukrotnie bardziej narażeni na wystąpienie cięższych postaci choroby niż osoby niepalące.[16] Składniki dymu tytoniowego, przede wszystkim nikotyna i tlenek węgla, to potwierdzone czynniki prozapalne; pod ich wpływem dochodzi do aktywacji szlaków odpowiedzi Th1-zależnej i uwalniania prozapalnych cytokin. Nikotyna powoduje skurcz naczyń krwionośnych, zaburza procesy angiogenezy poprzez upośledzenie ekspresji śródbłonkowego czynnika wzrostu naczyń i zwiększa krzepliwość krwi. Wyniki badań dotyczących wpływu alkoholu na prowokację i przebieg łuszczycy nie są jednoznaczne. Jak do tej pory nie jest jasne, czy spożywanie alkoholu prowokuje wystąpienie choroby, czy też obniżenie jakości życia w łuszczycy jest czynnikiem powodującym nadmierną konsumpcję alkoholu. Wydaje się, że oba mechanizmy leżą u podłoża tego związku. O ile, w kontekście ryzyka sercowo-naczyniowego, spożycie małych ilości alkoholu wydaje się wywierać działanie kardioprotekcyjne, to jego nadużywanie istotnie zwiększa ryzyko nadciśnienia tętniczego, zaburzeń rytmu i udaru krwotocznego.
Choroby współistniejące z łuszczycą
Liczne obserwacje kliniczne i badania epidemiologiczne wskazują jednoznacznie, że u chorych na łuszczycę występują podwyższone wartości ciśnienia tętniczego krwi, a w konsekwencji zwiększone ryzyko przedwczesnego zgonu z tego powodu.[17] Chociaż łuszczyca i nadciśnienie tętnicze mają wspólne czynniki ryzyka, takie jak palenie i otyłość, wykazano, że łuszczyca wykazuje niezależną korelację z nadciśnieniem tętniczym krwi. Dokładny mechanizm leżący u podłoża tego związku nie jest poznany. Istnieje kilka hipotez tłumaczących tę zależność. Zaburzenia w układzie renina-angiotensyna-aldosteron obserwowane w łuszczycy mogą odpowiadać za upośledzoną kontrolę ciśnienia tętniczego krwi. U pacjentów stwierdzono podwyższoną aktywność reniny w surowicy krwi i enzymu konwertującego angiotensynę (ACE, angiotensine converting enzyme).[18] Wysokie stężenie ACE może wpływać na regulację stężenia cytokin w układzie naczyniowym. Inna z hipotez tłumaczących współwystępowanie łuszczycy z nadciśnieniem tętniczym wskazuje na kluczową rolę endoteliny (E-1) w obu chorobach – peptydu produkowanego w nadmiarze przez komórki śródbłonka naczyń krwionośnych oraz stymulowane stanem zapalnym keratynocyty. Nadprodukcja E-1 prowadzi m.in. do skurczu naczyń tętniczych i żylnych, może także oddziaływać na proliferację śródbłonka w ścianach naczyń, działając proagregacyjnie, czego następstwem jest zwężenie światła naczyń krwionośnych i wzrost oporu naczyniowego, a w konsekwencji wzrost ciśnienia tętniczego krwi. Innym ważnym mechanizmem działania endoteliny zwiększającym ciśnienie krwi jest jej wpływ na wzrost napięcia ośrodkowego i obwodowego układu współczulnego oraz nasilenie wazokonstrykcyjnego działania noradrenaliny. Wykazano, że stężenie endoteliny-1 u chorych na łuszczycę jest zwiększone, zarówno w surowicy krwi, jak i w skórze zmienionej chorobowo, oraz że koreluje ono z ciężkością zmian skórnych.[19] Wspólny mechanizm nadciśnienia tętniczego oraz łuszczycy tłumaczony jest także stanem stresu oksydacyjnego, towarzyszącego obu schorzeniom. W łuszczycy dochodzi do zwiększonej produkcji wolnych rodników, czego wyrazem jest zwiększone stężenie markerów oksydacji w surowicy krwi. Powstające w nadmiarze reaktywne formy tlenu uszkadzają zależny od tlenku azotu proces rozkurczu naczyń krwionośnych. Oksydacja hamuje aktywność działającego antagonistycznie do E-1 tlenku azotu, który w warunkach normalnych rozszerza naczynia, zapobiegając zwyżkom ciśnienia tętniczego.[20]

