Zamówienia złożone w dniach 29.04 - 06.05 zostaną wysłane po 06.05. Aby zrekompensować te niedogodności, zamówienia złożone w tym terminie są objęte Majówkową Darmową Dostawą >
Niestety badania molekularne, które umożliwiają dokładną klasyfikację nowotworów endometrium, nie są powszechnie dostępne i użyteczne w praktyce klinicznej. Głównymi ograniczeniami w ich stosowaniu są drogie i mało dostępne badania genetyczne, a także konieczność prowadzenia diagnostyki na świeżym materiale.
Jak wprowadzić osiągnięcia biologii molekularnej do praktyki klinicznej?
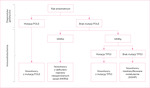
Ze względu na ograniczoną dostępność diagnostyki genetycznej istotne było opracowanie prostszych i tańszych metod klasyfikujących raki endometrium, które będą korespondowały z wynikami analiz TCGA. Tego rodzaju badania przeprowadzono niezależnie w ośrodkach holenderskich, głównie na uniwersytecie w Leiden, w ramach konsorcjum TransPORTEC10,11, oraz w Vancouver, przez zespół McAlpine i Talhouk, które opracowały algorytm Proactive Molecular Risk Classifier for Endometrial Cancer (ProMisE)12. Oba modele wyróżniają 4 grupy raków endometrium, które, choć nie są identyczne, korespondują z grupami ryzyka opracowanymi na podstawie analiz TCGA. W ramach badań konsorcjum TransPORTEC wyróżniono następujące grupy raków endometrium:
- nowotwory z mutacją w obrębie genu POLE
- nowotwory z deficytem naprawy niesparowanych zasad (MMRd – mismatch repair deficient). Nowotwory z mutacją w obrębie genów należących do systemu naprawy błędnie sparowanych zasad, które charakteryzują się niestabilnością mikrosatelitarną (MSI – microsatellite instability)
- nowotwory z mutacją p53
- nowotwory niesklasyfikowane pod względem molekularnym (NSMP – non-specific molecular profile).
W algorytmie ProMisE wyodrębniono tożsame grupy, z tym że grupa nowotworów niesklasyfikowanych (NSMP) jest określana jako „nowotwory z prawidłowym (wild-type) p53”10,12. Opracowane algorytmy pozwalają na klasyfikację zdecydowanej większości raków endometrium. Ocenia się, że jedynie 3-4% nowotworów nie udaje się zaklasyfikować na podstawie wymienionych wyżej algorytmów diagnostycznych10,12.
Istotą obu metod klasyfikacji jest ich prostota, ponieważ opierają się one na badaniach immunohistochemicznych (ocena immunoreaktywności p53 i białek związanych z systemem MMR [tj. MLH1, PMS2, MSH6 i MSH2]). Jedynym testem genetycznym jest analiza mutacji w obrębie genu POLE (ryc. 1).
W retrospektywnych analizach dotyczących modeli opracowanych przez konsorcjum TransPORTEC i algorytmu ProMisE wykazano różnice w przeżyciu pacjentek w zależności od molekularnej podgrupy raka endometrium. Rokowanie w poszczególnych podgrupach było podobne do rokowania w odpowiednich grupach wyróżnionych w badaniach TCGA. Mianowicie, wykazano bardzo pomyślne rokowanie w grupach chorych z mutacją genu POLE. Pacjentki z rakiem endometrium z rozpoznaną mutacją w obrębie genu białka p53 były narażone na duże ryzyko wznowy i charakteryzowały się najkrótszym czasem całkowitego przeżycia. Natomiast u pacjentek z rakiem endometrium z podtypem MSI oraz chorych z prawidłowym p53 (wild-type p53/NSMP) stwierdzono pośrednie rokowanie11,12.
Zastosowanie kliniczne profilowania molekularnego raków endometrium
Wydaje się, że szczególne korzyści wynikają z identyfikacji mutacji w obrębie genu POLE. Jak wspomniano wcześniej, mutacja w obrębie genu POLE dotyczy głównie młodych kobiet, u których rozpoznaje się nowotwory nisko zróżnicowane z głębokim naciekiem miometrium. Posługując się oceną ryzyka opartą na badaniu histopatologicznym materiału pooperacyjnego, w tej grupie pacjentek stwierdza się zwykle wskazania do adiuwantowej teleterapii, a często też do chemioterapii. W związku z tym wiedza na temat obecności mutacji w obrębie genu POLE daje szanse na odstąpienie od agresywnego leczenia uzupełniającego. Zgodnie z aktualnymi wytycznymi ESGO/ESTRO/ESP z 2021 roku pacjentki z rakiem endometrium w stadium I-II według klasyfikacji Fédération Internationale de Gynécologie et d’Obstétrique (FIGO), z nowotworem endometrialnym, niezależnie od stopnia zróżnicowania, w przypadku braku choroby resztkowej po zabiegu operacyjnym z rozpoznaną mutacją w obrębie genu POLE klasyfikowane są do grupy niskiego ryzyka i w tej grupie należy rozważyć odstąpienie od terapii adiuwantowej2.
Raki endometrium z mutacją w obrębie genu białka p53 w zdecydowanej większości klasyfikowane są jako nowotwory wysokiego ryzyka na podstawie tradycyjnej oceny histopatologicznej14. W badaniu Talhouk i wsp. nowotwory z nieprawidłowym białkiem p53 w 96% przypadków były nowotworami G3, w 80,2% nowotworami nieendometrialnymi, w 61% przypadków stwierdzono naciekanie LVSI i charakteryzowały się wysokim odsetkiem przerzutów do węzłów chłonnych12. Niemniej u części pacjentek z nowotworami ocenionymi na podstawie badania histopatologicznego jako niskiego/pośredniego ryzyka rozpoznanie mutacji w obrębie p53 będzie skutkowało zmianą klasyfikacji i pojawieniem się wskazań do terapii adiuwantowej.
W przypadku raków endometrium z podtypem z MSI należy wskazać dodatkowe korzyści związane z profilowaniem molekularnym raków endometrium i rozpoznaniem nowotworów z MSI. Do tej grupy pacjentek należą chore z nowotworami powstałymi na podłożu wrodzonych mutacji w obrębie genów MMR, odpowiadających za zespół Lyncha. Wiedza na temat genetycznego podłoża choroby pozwala na zaplanowanie dodatkowej opieki nad pacjentką obejmującej profilaktykę innych nowotworów związanych z zespołem Lyncha, a także na zapewnienie poradnictwa genetycznego członkom jej rodziny.
Wnioski
Pojawia się istotne pytanie: czy można już stosować molekularną klasyfikację raków endometrium, skoro została ona wykorzystana w wytycznych ESGO/ESTRO/ESP do oceny ryzyka wznowy tego nowotworu? Stosowanie klasyfikacji molekularnej jest bardzo obiecujące na przyszłość, jednakże należy zachować ostrożność przy podejmowaniu decyzji klinicznych z powodu przede wszystkim braku prospektywnych badań dotyczących użyteczności klinicznej diagnostyki molekularnej. Takie badania są obecnie prowadzone (PORTEC-4a)15. Jest bardzo prawdopodobne, że jeśli potwierdzą one wyniki uzyskane w badaniach retrospektywnych, to klasyfikacja molekularna będzie przełomem w odniesieniu do terapii uzupełniającej pacjentek z rakiem endometrium. Podsumowując, należy wskazać, że pełny zakres możliwości wykorzystania klasyfikacji molekularnej zostanie opracowany po uzyskaniu wyników randomizowanych badań prospektywnych.