Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Zakażenia dróg oddechowych u chorych na mukowiscydozę – część 1
dr n. med. Justyna Milczewska1,2
lek. Malwina Maja Dawidziuk2
- Omówienie najczęstszych patogenów wywołujących infekcje dróg oddechowych u chorych na mukowiscydozę
- Podstawowe zasady diagnostyki i leczenia zakażeń dróg oddechowych w tej grupie pacjentów oraz zapobieganie zakażeniom krzyżowym
- Zastosowanie antybiotyków w terapii zaostrzeń choroby oskrzelowo-płucnej u pacjentów z mukowiscydozą
Mukowiscydoza (CF – cystic fibrosis) to uwarunkowana genetycznie choroba o przewlekle postępującym przebiegu. Jest to najczęstsze u ludzi rasy kaukaskiej schorzenie o autosomalnym recesywnym typie dziedziczenia (częstość CF w Polsce wynosi 1:4394-1:5000 żywych urodzeń).
Za wystąpienie objawów klinicznych odpowiadają mutacje w obu allelach genu CFTR (cystic fibrosis transmembrane conductance regulator), zlokalizowanego na długim ramieniu chromosomu 7. Obecnie znanych jest ponad 2000 mutacji tego genu, a najczęstszą z nich jest F508del, która występuje w ponad 60% zmutowanych alleli. Produktem genu jest białko CFTR – kanał chlorkowy, którego aktywność jest kluczowa dla zachowania równowagi między wchłanianiem a wydzielaniem elektrolitów oraz wody przez nabłonki przewodów wyprowadzających gruczołów zewnątrzwydzielniczych. Defekt genu CFTR wpływa na zaburzenie produkcji, funkcji lub transportu białka CFTR, a jego dysfunkcja skutkuje zaburzeniami transportu jonowego na szczytowej powierzchni nabłonka wydzielniczego. Kumulacja gęstej i lepkiej wydzieliny prowadzi do upośledzenia drożności, przewlekłego stanu zapalnego i destrukcji przewodów wyprowadzających gruczołów zewnątrzwydzielniczych. CF objawia się przewlekłymi, postępującymi zmianami w układzie oddechowym pod postacią obturacji oskrzeli i przewlekłego stanu zapalnego dróg oddechowych (przewlekła choroba oskrzelowo-płucna), niewydolnością zewnątrzwydzielniczą trzustki i w konsekwencji zespołem niedożywienia oraz dużym stężeniem jonów sodowych i chlorkowych w pocie. Ponadto na obraz klasycznej postaci choroby składają się: zastój żółci mogący prowadzić do żółciowej marskości wątroby, polipowatość zatok przynosowych, cukrzyca, niepłodność męska i inne objawy1.
Przewlekłe zakażenie patogennymi szczepami bakteryjnymi odgrywa kluczową rolę w zapoczątkowaniu i w dalszym rozwoju tej przewlekłej choroby oskrzelowo-płucnej. Istnieje wiele hipotez tłumaczących fakt, że drogi oddechowe pacjentów z rozpoznaną CF charakteryzują się zwiększoną podatnością na zakażenia, głównie bakteryjne, ale również wirusowe i grzybicze. Wymienia się kilka prawdopodobnych czynników, takich jak:
- zaburzony klirens śluzowo-rzęskowy
- zaburzona sekrecja mucyn powodująca odsłonięcie nabłonka, co sprzyja powstawaniu biofilmu
- zaburzona internalizacja bakterii przez komórki nabłonka i neutrofile
- hipoksja wewnątrz warstwy śluzu2,3.
Zakażenie dróg oddechowych gronkowcem złocistym i pałeczką hemofilną
W pierwszych latach życia patogenem najczęściej izolowanym z dróg oddechowych jest gronkowiec złocisty (Staphylococcus aureus). Uważa się, że infekcja nim spowodowana dotyczy nawet do 80% dzieci z CF (ryc. 1). Zaostrzenia u chorych z zakażeniem gronkowcem złocistym wrażliwym na metycylinę (MSSA – methicillin-sensitive Staphylococcus aureus) zazwyczaj łatwo poddają się ambulatoryjnej antybiotykoterapii. W przypadku zakażeń MSSA nie zaleca się leczenia eradykacyjnego przy pierwszej dodatniej hodowli ani profilaktyki pierwotnej zakażenia tym patogenem (wyjątkiem są ośrodki brytyjskie)4,5. Odradza się także stosowanie przewlekłej antybiotykoterapii, nawet jeśli dowody potwierdzają utrwalenie się infekcji.
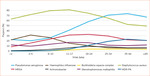
Rycina 1. Częstość występowania zakażeń dróg oddechowych u chorych na mukowiscydozę w zależności od wieku (według Cystic Fibrosis Foundation Patient Registry 2015)
Coraz większy problem stanowi oporność gronkowca złocistego na metycylinę u chorych na CF, czyli zwiększenie częstości izolacji szczepów MRSA (methicillin-resistant Staphylococcus aureus). Udowodniono, że przewlekłe zakażenie MRSA skutkuje pogorszeniem funkcji płuc oraz parametrów rozwoju somatycznego u dzieci. Ponadto obserwuje się zwiększoną częstość stosowania antybiotyków u tych chorych i ich hospitalizacji. Należy także podkreślić, że przewlekła infekcja MRSA może się wiązać z poważnymi powikłaniami zagrażającymi życiu pacjentów poddawanych leczeniu immunosupresyjnemu po przeszczepieniu narządów. Z tego powodu w przypadku pierwszorazowego wyhodowania MRSA z dróg oddechowych zawsze zaleca się podjęcie próby jego eradykacji. W ostatnich latach najczęściej proponowanym schematem jest stosowanie ryfampicyny w połączeniu z kotrimoksazolem oraz leczeniem wspomagającym (mupirocyną podawaną miejscowo do jamy nosowej oraz preparatami chlorheksydyny do płukania jamy ustnej i dezynfekcji skóry), a także zaleca się dekontaminację środowiska, w którym żyje pacjent6,7.
W pierwszych latach, a nawet miesiącach, życia równie częsta jest infekcja pałeczką hemofilną (Haemophilus influenzae). Skutki tego zakażenia dróg oddechowych są trudne do oceny ze względu na współistnienie innych infekcji, jednak nie wykazano związku zakażenia H. influenzae ze zwiększeniem chorobowości i śmiertelności w populacji pacjentów z CF. Antybiotykoterapia jest konieczna tylko w przypadku zaostrzenia choroby oskrzelowo-płucnej2,4.
Zakażenie dróg oddechowych pałeczką ropy błękitnej
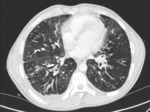
Rycina 2. Skan tomografii komputerowej klatki piersiowej 16-letniego pacjenta z przewlekłym zakażeniem Pseudomonas aeruginosa i Achromobacter xylosoxidans oraz z bardzo zaawansowaną chorobą oskrzelowo-płucną
Wraz z wiekiem pacjentów rośnie częstość występowania zakażeń spowodowanych Gram(–) pałeczkami niefermentującymi. Stanowią one poważny problem kliniczny u chorych na CF, gdyż znacząco pogarszają rokowanie, a ich narastająca oporność na antybiotyki znacznie ogranicza możliwości leczenia. Zdecydowanie najczęściej rozpoznaje się zakażenie wywołane pałeczką ropy błękitnej (Pseudomonas aeruginosa). Przewlekłe zakażenie P. aeruginosa zwiększa częstość zaostrzeń w CF, przyspiesza postęp choroby i zwiększa śmiertelność wśród pacjentów z CF (ryc. 2). W przebiegu infekcji P. aeruginosa u chorych na CF można wyodrębnić następujące stadia:
- zakażenie pierwszorazowe
- zakażenie okresowe – liczba dodatnich posiewów w kierunku tego patogenu nie przekraczała 50% w ostatnim roku
- pacjent wolny od zakażenia – patogen hodował się w przeszłości, ale nie w ciągu ostatniego roku
- zakażenie przewlekłe (utrwalone) – liczba dodatnich posiewów w kierunku tego patogenu przekraczała 50% w ostatnim roku2,4,5.
W początkowej fazie zakażenia P. aeruginosa hoduje się incydentalnie, a komórki bakteryjne występują w formie planktonicznej (komórki wolno żyjące), ich adhezja do podłoża jest odwracalna, a zjawisko antybiotykooporności występuje rzadko. Na tym etapie u dużego odsetka pacjentów można z powodzeniem przeprowadzić eradykację patogenu z dróg oddechowych za pomocą agresywnego leczenia przeciwbakteryjnego. Dlatego też w każdym przypadku zakażenia pierwszorazowego konieczne jest jak najszybsze wdrożenie intensywnej antybiotykoterapii w celu eradykacji P. aeruginosa. W schematach postępowania najczęściej zaleca się skojarzenie cyprofloksacyny przyjmowanej doustnie (przez 3 tygodnie) z antybiotykiem wziewnym (kolistyną bądź tobramycyną stosowanymi przez 1-3 miesiące). Antybiotykoterapia dożylna (za pomocą ceftazydymu lub piperacyliny z inhibitorem β-laktamazy w połączeniu z aminoglikozydem) jest zarezerwowana dla niemowląt i małych dzieci, u których zastosowanie doustnie podawanej cyprofloksacyny jest niemożliwe (lek w postaci syropu jest niedostępny w Polsce), a ponadto dla pacjentów z pierwszorazowym zakażeniem P. aeruginosa, któremu towarzyszą objawy kliniczne zaostrzenia choroby oskrzelowo-płucnej, a także w przypadku niepowodzenia eradykacji tego patogenu drogą doustną i wziewną4,8.

