Zamówienia złożone w dniach 29.04 - 06.05 zostaną wysłane po 06.05. Aby zrekompensować te niedogodności, zamówienia złożone w tym terminie są objęte Majówkową Darmową Dostawą >
- Spirometria – szeroki dostęp do spirometrów spowodował, że najbardziej uznanym rokowniczo parametrem czynnościowym jest roczna utrata natężonej pojemności życiowej płuc (FVC – forced vital capacity). Proporcjonalne zmniejszenie FVC i pierwszosekundowej natężonej objętości wydechowej (FEV1 – forced expiratory volume in one second) sugeruje zaburzenia typu restrykcyjnego i może występować u pacjentów z ILD. Jednak prawidłowy wynik spirometrii nie wyklucza wczesnej postaci ILD w przebiegu SSc. Jedno z badań wykazało, że 62% pacjentów z SSc z prawidłową FVC miało klinicznie istotną ILD zidentyfikowaną w HRCT13.
- Pletyzmografia – ocena całkowitej pojemności płuc (TLC – total lung capacity) jest przeprowadzana w celu potwierdzenia restrykcji.
- Ocena wskaźnika transferu płucnego dla tlenku węgla (TLCO – transfer factor of the lung for carbon monoxide) – obniżenie TLCO może być pierwszą nieprawidłowością obserwowaną w ILD związanej z SSc, ale jest niespecyficzne; inne procesy (np. nadciśnienie płucne, palenie papierosów, choroba zakrzepowo-zatorowa) również mogą powodować obniżenie TLCO. Wśród pacjentów z ILD związaną z SSc zmniejszenie TLCO jest zwykle proporcjonalne do zmniejszenia objętości płuc. Ponadto spadek TLCO koreluje z nasileniem ILD w HRCT i jest złym rokowniczo predyktorem.
- Test 6-minutowego chodu (6MWT – 6-minute walk test) – jest wystandaryzowany i dość łatwy do przeprowadzenia: podczas marszu trwającego 6 minut ocenia się przebyty dystans (w metrach) oraz stopień obniżenia wysycenia krwi tętniczej tlenem mierzony pulsoksymetrem (delta SaO2). Ocena SaO2 może być problematyczna u pacjentów z SSc ze względu na objaw Raynauda i słabą perfuzję palca. Jeśli dostępna jest odpowiednia nasadka, skuteczniejszy może być pomiar za pomocą klipsa przymocowanego do płatka ucha. Desaturacja podczas wysiłku jest wspólna zarówno dla ILD, jak i nadciśnienia płucnego.
Możliwości terapeutyczne w SSc
Relatywnie gorsze w porównaniu z innymi układowymi chorobami tkanki łącznej wyniki terapii SSc wiążą się z brakiem leczenia przyczynowego. Mimo znacznego postępu badań wciąż nie opracowano skutecznego leczenia przeciwzwłóknieniowego, a terapia jest uzależniona od stopnia zajęcia poszczególnych narządów i układów (tzw. terapia narządowo swoista). Szczególnie ważne jest leczenie farmakologiczne chorób układu oddechowego (śródmiąższowe włóknienie płuc) oraz sercowo-naczyniowego (tętnicze nadciśnienie płucne, zaburzenia rytmu serca i przewodzenia) ze względu na bezpośredni wpływ na długość życia pacjentów. Z drugiej strony zajęcie skóry (postępujące stwardnienie, objaw Raynauda i owrzodzenia) oraz układu ruchu (zapalenia stawów i ścięgien) mogą istotnie ograniczać jakość życia pacjentów, zwłaszcza na początku choroby. Stopień i dynamika zmian skórnych stanowią ponadto wykładnik aktywności SSc oraz korelują z zajęciem narządów wewnętrznych i śmiertelnością, przede wszystkim w postaci uogólnionej choroby.
W monitorowaniu postępu zmian skórnych stosuje się powszechnie tzw. zmodyfikowaną skalę Rodnana (mRSS – modified Rodnan Skin Score)14. Przeprowadzając badanie z wykorzystaniem mRSS, ocenia się napięcie skóry (0 – prawidłowe, 1 – łagodne, 2 – umiarkowane, 3 – znacznie zwiększone) w 17 obszarach obejmujących całą powierzchnię ciała. Wynik skali mieści się w zakresie od 0 do 51 pkt, przy czym wartości powyżej 20 pkt świadczą o znacznym zaawansowaniu choroby. W ostatnim czasie (pandemia COVID-19) wykazano przydatność uproszczonego testu, który pacjent może wykonać samodzielnie (PASTUL – Patient self-Assessment of Skin Thickness in Upper Limb). Ocenia się w nim jedynie 4 obszary na każdej kończynie górnej (palce, ręka, przedramię i ramię; zakres wartości 0-24 pkt). PASTUL może stanowić cenne narzędzie diagnostyczno-monitorujące w czasie teleporady15.
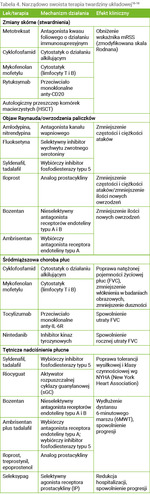
Leki stosowane w terapii SSc wybranych układów i narządów zestawiono w tabeli 4.
W ostatnim czasie duże nadzieje wiąże się z autologicznym przeszczepieniem komórek macierzystych (HSCT – hematopoietic stem cell transplantation). Według europejskiego rejestru autologicznych przeszczepień szpiku (EBMT – European Society for Blood and Marrow Transplantation) w ostatnich latach w Europie wykonano łącznie 2809 procedur – najwięcej u pacjentów ze stwardnieniem rozsianym (50%), na drugim miejscu znalazły się osoby z chorobami tkanki łącznej (27%), wśród których znaczącą większość stanowią chorzy na SSc (79%)19.
W ciągu ostatnich 20 lat terapia HSCT była adresowana do pacjentów z ciężką i szybko postępującą SSc20. Według danych z międzynarodowych rejestrów liczba pacjentów po przeszczepie z roku na rok stopniowo wzrasta, co jest również dowodem na dobre wyniki związane z zastosowaniem tej opcji terapeutycznej21.
Wskazania do HSCT obejmują pacjentów20,22,23:
- z potwierdzoną diagnozą SSc, zgodnie z kryteriami ACR/EULAR z 2013 r.9
- z układową postacią choroby, którzy w ocenie mRSS uzyskali co najmniej 16 pkt oraz doświadczyli pogorszenia o co najmniej 25% w ciągu ostatnich 6 miesięcy w trakcie leczenia immunosupresyjnego
- ze śródmiąższowym zajęciem płuc, ze spadkiem FVC lub TLCO o więcej niż 10% w ostatnich 6 miesiącach, w trakcie leczenia immunosupresyjnego.
Główne przeciwwskazania do HSCT obejmują20,22,23: podeszły wiek, ciężkie zaburzenia psychiczne, infekcje, choroby nowotworowe, niewydolność wątroby, nerek, układu oddechowego lub znaczne uszkodzenie serca.
O skuteczności HSCT u chorych na SSc mogą świadczyć wyniki badań ASTIS (Autologous Stem Cell Transplantation International Scleroderma) i SCOT (Scleroderma: Cyclophosphamide Or Transplantation), w których poddano leczeniu 231 pacjentów, z czego połowa miała wykonane HSCT, a druga połowa była leczona cyklofosfamidem. Odsetek przeżyć wyniósł 80% dla HSCT i 65% dla cyklofosfamidu w obserwacji 4-letniej22. W innej kohorcie wynik różnił się jeszcze istotniej i wyniósł 86% dla HSCT i 51% dla cyklofosfamidu w obserwacji 6-letniej24.
Doświadczenia z allogenicznym przeszczepieniem szpiku ograniczają się do pojedynczych opisów przypadków, dlatego dowody kliniczne są niewystarczające, aby zalecać ten sposób transplantacji szpiku u chorych na SSc21,25,26.
Zasady postępowania w SSc-ILD
Zasadniczym postępowaniem w SSc-ILD jest leczenie immunosupresyjne. W randomizowanych badaniach klinicznych nad SSc-ILD wykazano, że u chorych leczonych cyklofosfamidem uzyskano wolniejszy spadek FVC po roku leczenia w porównaniu z grupą placebo, a w badaniu oceniającym skuteczność 2-letniego leczenia mykofenolanem mofetylu w odniesieniu do rocznego leczenia cyklofosfamidem wykazano porównywalny efekt działania obu leków przy mniejszej toksyczności pierwszego z nich17.
Interesującą nową opcją terapeutyczną w SSc-ILD jest zastosowanie tocylizumabu – humanizowanego przeciwciała monoklonalnego wiążącego receptory dla interleukiny 6, leku biologicznego zarejestrowanego wcześniej w reumatoidalnym zapaleniu stawów (RZS), młodzieńczym idiopatycznym zapaleniu stawów, olbrzymiokomórkowym zapaleniu tętnic, a ostatnio również w najcięższych postaciach COVID-19. Tocylizumab okazał się nieskuteczny w hamowaniu progresji zmian skórnych, jednak jego podanie wiązało się z istotną statystycznie redukcją pogorszenia czynności płuc (hamowanie spadku FVC). Uzyskane dane pozwoliły na rejestrację przez amerykańską Agencję ds. Żywności i Leków (FDA – Food and Drug Administration) w 2021 r. tocylizumabu w postaci podskórnej u pacjentów z SSc-ILD27.
Kolejnym obiecującym lekiem biologicznym stosowanym dotychczas u pacjentów z RZS, który potencjalnie może okazać się skuteczny w terapii ILD związanej z SSc, jest rytuksymab – przeciwciało monoklonalne powodujące deplecję limfocytów B poprzez wiązanie się z przezbłonowym antygenem CD20. W niewielkim japońskim badaniu klinicznym rytuksymab poprawiał zarówno stan skóry (obniżenie wskaźnika mRSS), jak i wyniki badań czynnościowych (FVC) i obraz radiologiczny płuc28.
Obserwacje pacjentów z SSc-ILD wskazują, że ok. 30% chorych doświadcza progresji ILD w pierwszych 12 miesiącach obserwacji, a nawet 67% w okresie średnio 5 lat29. Pacjent z rozpoznaniem SSc-ILD powinien być monitorowany. Monitorowanie obejmuje ocenę objawów (tolerancji wysiłku, nasilenia kaszlu), szeroko pojęte badania czynnościowe płuc (np. FVC, TLCO, 6MWT) oraz w uzasadnionych przypadkach HRCT klatki piersiowej. Nie ma ustalonych wytycznych dotyczących częstości wykonywania badań kontrolnych w ILD. Zasadne wydaje się planowanie oceny klinicznej i czynnościowej (spirometria, dyfuzja) co 6-12 miesięcy, natomiast radiologicznej (HRCT) co rok-2 lata. W wybranych przypadkach, gdy narastają objawy lub istnieją czynniki ryzyka progresji, monitorowanie należy zaplanować indywidualnie.
Chorzy, u których stwierdza się progresję śródmiąższowego włóknienia płuc, powinni być kwalifikowani do leczenia antyfibrotycznego nintedanibem (patrz niżej).