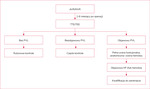
Rycina 1 ilustruje zalecane postępowanie kontrolne w ramach follow-up, zaproponowane w stanowisku ekspertów dotyczącym zasad badań klinicznych i definicji punktów końcowych dla PVL6.
Echokardiografia przezprzełykowa jest wykorzystywana w celu uzyskania ewentualnych dodatkowych danych i zawsze jako badanie śródzabiegowe w trakcie przezcewnikowego zamykania PVL. Jak wspomniano, metoda ta wiąże się jednak z ograniczonymi możliwościami obrazowania przedniego pierścienia aortalnego, natomiast jest lepsza do oceny PVL w pozycji mitralnej i trójdzielnej oraz może być skuteczniejsza w ocenie tylnego pierścienia aortalnego. Echokardiografia 3D jest wykorzystywana do oceny rozmiaru i ustalenia lokalizacji przecieku6. W tabelach 1 i 2 zestawiono parametry echokardiograficzne brane pod uwagę w czasie oceny – w celu określenia stopnia istotności PVL.

Tabela 1. Wybrane parametry echokardiograficzne wykorzystywane w ocenie stopnia aortalnego przecieku okołozastawkowego7

Tabela 2. Wybrane parametry echokardiograficzne wykorzystywane w ocenie stopnia mitralnego przecieku okołozastawkowego7
Kolejnym badaniem wykorzystywanym w diagnostyce PVL jest tomografia komputerowa. Ma ona podobną czułość, specyficzność, pozytywną i negatywną wartość predykcyjną oraz dokładność diagnostyczną w wykrywaniu PVL jak echokardiografia przezprzełykowa 2D.
W opisie badania tomografii komputerowej pod kątem oceny PVL powinno się zawrzeć m.in. następujące (najważniejsze) punkty:
- rozpoznanie przecieku (przede wszystkim)
- opis wszczepionej zastawki ze szczególnym uwzględnieniem jej stabilności
- opis struktur przylegających
- pomiary PVL – rozmiar, kształt, odległość od pierścienia zastawkowego
- dodatkowe czynniki mogące mieć wpływ na komplikacje podczas procedury, takie jak zwapnienia otaczające PVL, kąt kanału przecieku, obecność innych sztucznych zastawek serca i okluderów w przegrodzie międzyprzedsionkowej.
Ponadto, biorąc pod uwagę najczęściej stosowane obecnie metody zamykania przecieków, czyli metody przezcewnikowe, możliwa jest pełna ocena tomograficzna pod kątem tego rodzaju zabiegu, uwzględniająca planowanie miejsca punkcji koniuszka lub przegrody międzyprzedsionkowej, wybór i wymiarowanie okludera oraz dobór optymalnych ustawień fluoroskopu2.
W stosunku do echokardiografii tomografia komputerowa ma jednak pewne ograniczenia. W badaniu tomograficznym nie da się uwidocznić przepływu krwi, badanie jest bardziej inwazyjne, ponieważ wymaga podania środka kontrastowego i wykorzystania promieniowania, a żeby uzyskać wszystkie potrzebne informacje, konieczny jest opis wykonany przez doświadczonego radiologa6. Pozostaje jednak bardzo dobrą metodą do oceny anatomicznej przecieku (lokalizacja, rozmiar), zwłaszcza przy zastawkach mechanicznych, które dają artefakty w ultrasonografii. Ponadto tomografia komputerowa po dodatkowej obróbce obrazów pozwala na stworzenie pliku będącego źródłem danych do wykorzystania w celu wytworzenia modelu przy użyciu technologii druku 3D. Może to być kolejne narzędzie stosowane w ramach planowania procedury zamknięcia ubytku. Druk 3D i modelowanie trójwymiarowe coraz częściej wykorzystuje się przy planowaniu wielu procedur zabiegowych, jednak tego rodzaju rozwiązania na razie nie są zbyt popularne w przypadku PVL. Jak wynika z pracy Hascoëta i wsp. zawierającej rady proceduralne uzyskane od 12 najbardziej doświadczonych operatorów z 11 krajów, jedynie 5 z nich wykorzystuje w praktyce druk 3D, i to tylko w wyjątkowych przypadkach. Sześciu pytanych nigdy nie stosowało tej technologii przy planowaniu zabiegu8.
Ostatnim, najrzadziej wykorzystywanym badaniem obrazowym w rozpoznawaniu i ocenie PVL jest rezonans magnetyczny serca. Najmniejsza popularność tej metody wynika z niewystarczającej dostępności, długiego czasu badania oraz konieczności wykonania opisu przez doświadczonego radiologa. Rezonans magnetyczny serca stanowi bardzo dobrą metodę w zakresie dokładnej ilościowej oceny fali regurgitacji i jest szczególnie użyteczny w określaniu objętości („ciężkości”) fali zwrotnej w przypadkach wątpliwych echokardiograficznie lub gdy obraz echo nie pokrywa się z objawami klinicznymi bądź stopniem poszerzenia lewej komory. Ma jednak ograniczenia wynikające z artefaktów pochodzących od pierścieni oraz słabej rozdzielczości przestrzennej w porównaniu z tomografią komputerową6.
Bardzo ważna w diagnostyce PVL, a następnie planowaniu leczenia zabiegowego jest unifikacja opisów pod kątem lokalizacji przecieku. W przypadku zastawki aortalnej w echokardiografii przezprzełykowej wykorzystuje się projekcję na zastawkę w osi krótkiej i lokalizuje przecieki w stosunku do odpowiadających zatok aorty (prawowieńcowa, lewowieńcowa i niewieńcowa). Zastawka mitralna jest opisywana analogicznie do widoku chirurgicznego z zastawką aortalną na godzinie 12 i uszkiem lewego przedsionka na godzinie 9. Obwód pierścienia mitralnego podzielono na część przednią przylegającą do aorty, boczną od strony uszka lewego przedsionka, przyśrodkową sąsiadującą z przegrodą międzyprzedsionkową i tylną na godzinie 6.
Jak wspomniano, drugim po niewydolności serca przejawem PVL jest hemoliza. W zależności od wielu czynników może ona przyjmować różne postaci: od bezobjawowej, przez przebiegającą z niewielką niedokrwistością, aż do pełnoobjawowej niedokrwistości hemolitycznej wymagającej powtarzanych przetoczeń preparatów krwi. Po wykryciu obecności PVL w badaniu echo, przy braku objawów niewydolności serca, diagnostyka hemolizy może pomóc w ocenie istotności przecieku. W przypadku wątpliwości bezobjawową hemolizę można rozpoznać na podstawie obniżonego stężenia hemoglobiny (<13,8 g/dl u mężczyzn i <12,4 g/dl u kobiet), podwyższonej aktywności dehydrogenazy mleczanowej (LDH – lactic dehydrogenase >460 j./l), obniżonego stężenia haptoglobiny w osoczu (<50 mg/dl), wzrostu liczby retikulocytów (>2%) i stężenia bilirubiny (>1,2 mg/dl). Dodatkowo wzrost stężenia wolnej osoczowej hemoglobiny >40 mg/dl oraz obecność schistocytów (fragmentowanych erytrocytów) w rozmazie krwi obwodowej sugerują hemolizę3.
Wskazania do interwencji
Nie każdy PVL jest wskazaniem do interwencji chirurgicznej lub przezcewnikowej. Chociaż żadne leczenie zachowawcze nie jest w stanie doprowadzić do zamknięcia przecieku, terapia objawowa niewydolności serca oraz hemolizy odgrywa istotną rolę w postępowaniu9. W przypadku istotnej klinicznie hemolizy bez współistniejących objawów niewydolności krążenia przed leczeniem zabiegowym można podjąć próbę leczenia zachowawczego. Zwolnienie akcji serca (zastosowanie β-adrenolityków) może zmniejszyć stopień hemolizy. Dodatkowo istotna w takich przypadkach jest suplementacja żelaza i kwasu foliowego. W opornej na terapię hemolizie wykazano, że zastosowanie erytropoetyny redukuje konieczność reoperacji. W przypadku objawowej niedokrwistości hemolitycznej leczeniem jest transfuzja koncentratu krwinek czerwonych. Niedokrwistość hemolityczna wymagająca powtarzanych przetoczeń preparatów krwi stanowi wskazanie do interwencji zabiegowej2.
Stosuje się dwie metody zamknięcia PVL: reoperację chirurgiczną i metodę przezcewnikową.
W opublikowanych w 2025 r. wytycznych ESC znajdują się również zalecenia postępowania w przypadku stwierdzenia PVL. Przede wszystkim zaleca się, aby decyzję co do sposobu leczenia (chirurgiczne lub przezcewnikowe) podejmować na posiedzeniu kardiogrupy (heart team) po ocenie ryzyka, morfologii przecieku oraz doświadczenia ośrodka. Reoperację zaleca się, jeżeli PVL jest związany z zapaleniem wsierdzia lub powoduje hemolizę wymagającą powtarzanych przetoczeń krwi bądź prowadzącą do nasilonych objawów niewydolności serca. Należy rozważyć przezcewnikowe zamknięcie kwalifikującego się do takiego leczenia PVL z istotną klinicznie falą zwrotną i/lub hemolizą – w poprzednich wytycznych z 2021 r. zalecenie to obejmowało pacjentów z dużym lub wykluczającym ryzykiem operacyjnym; obecnie zawsze gdy jest to technicznie możliwe, należy rozważyć interwencję małoinwazyjną4.
Wytyczne Amerykańskiego Kolegium Kardiologii/Amerykańskiego Towarzystwa Kardiologicznego (ACC/AHA – American College of Cardiology/American Heart Association) pochodzą z 2020 r. i różnią się od aktualnych wytycznych europejskich w dość znacznym stopniu. Przede wszystkim zaleceniem klasy I u pacjentów z nasiloną hemolizą lub niewydolnością serca w wyniku PVL jest reoperacja chirurgiczna, jeżeli ryzyko zabiegu nie jest wysokie lub zaporowe. Ponadto operację należy rozważyć u pacjentów bezobjawowych z istotnym PVL i niskim ryzykiem chirurgicznym. Leczenie przezcewnikowe należy rozważyć jedynie u chorych z wysokim ryzykiem chirurgicznym, anatomicznie nadających się do takiego postępowania, i w doświadczonych ośrodkach5. Przyczyna tych różnic będzie przedstawiona w dalszej części artykułu.