Opis przypadku
Postać klasyczna mięsaka Kaposiego u 86-letniej pacjentki z zaburzeniami krążenia limfatycznego
Lek. Patrycja Lemiesz1
Dr n. med. Małgorzata Szterling-Jaworowska1
Dr hab. med. Hanna Myśliwiec1
Lek. Agata Piłaszewicz-Puza2
Prof. dr hab. med. Iwona Flisiak1
Mięsak Kaposiego (Kaposi sarcoma, KS) należy do niskozróżnicowanych nowotworów pochodzenia naczyniowego. Patogeneza KS pozostaje nie do końca wyjaśniona, związana jest jednak z zakażeniem ludzkim wirusem opryszczki typu 8 (HHV8). Zmiany skórne mają charakter purpurowych, sinoczerwonych lub brązowoczarnych plam, grudek i guzków ze skłonnością do krwawienia i owrzodzeń, najczęściej zlokalizowanych w obrębie skóry kończyn dolnych.
Przedstawiamy przypadek 86-letniej chorej z towarzyszącymi zaburzeniami krążenia limfatycznego, u której na podstawie obrazu klinicznego i badania histopatologicznego rozpoznano mięsaka Kaposiego. Na podstawie dostępnego piśmiennictwa omówiono postacie kliniczne, częstotliwość występowania, patogenezę, rozpoznanie różnicowe i leczenie tej choroby.
Mięsak Kaposiego (Kaposi sarcoma, KS) należy do niskozróżnicowanych nowotworów wywodzących się z komórek limfatycznych śródbłonka naczyń. Jego występowanie jest związane z zakażeniem ludzkim herpeswirusem typu 8 (Kaposi sarcoma herpesvirus/human herpesvirus 8 – KSHV/HHV8).[1] Sama obecność wirusa HHV-8 nie jest wystarczająca do rozwoju nowotworu. Istotną rolę w patogenezie choroby jako kokarcynogeny odgrywają także czynniki genetyczne, środowiskowe, immunologiczne, przyjmowane leki czy zaburzenia krążenia limfatycznego.[2] Zmiany skórne mają charakter purpurowych, sinoczerwonych lub brązowoczarnych plam, grudek i guzków, skłonnych do krwawienia i owrzodzeń. Najczęściej lokalizują się w obrębie skóry i błon śluzowych, ale mogą także zajmować przewód pokarmowy i węzły chłonne.[3] Wśród manifestacji epidemiologiczno-klinicznych wyróżniamy cztery postacie KS:
- klasyczna – typowo występująca wśród starszych Żydów płci męskiej lub europejskich mieszkańców basenu Morza Śródziemnego,
- endemiczna – stanowi jeden z najczęstszych nowotworów u mieszkańców Afryki Równikowej,
- jatrogenna – związana z immunosupresją, najczęściej u pacjentów po przeszczepieniach narządów miąższowych,
- epidemiczna – obserwowana u osób z zespołem nabytego upośledzenia odporności (acquired immunodeficiency syndrome, AIDS).[4]
Ostatnio postuluje się uznanie piątego wariantu choroby – nieepidemicznego KS pod względem klinicznym przypominającego postać klasyczną, jednak występującego u mężczyzn homoseksualnych (men who have sex with men – MSM), bez infekcji HIV i innych deficytów odporności.[3]
Opis przypadku
86-letnia pacjentka pochodzenia polskiego z wieloletnim wywiadem nadciśnienia tętniczego leczonego preparatami nebiwololu, torasemidu i perindoprilu, w stanie ogólnym dobrym została przyjęta do Kliniki Dermatologii i Wenerologii UMB z powodu utrzymujących się od około czterech miesięcy zmian skórnych zlokalizowanych w obrębie lewej kończyny dolnej oraz obrzęków obu kończyn dolnych. Przy przyjęciu badaniem dermatologicznym stwierdzono w obrębie lewego podudzia i stopy liczne, dobrze odgraniczone od otoczenia sinofioletowe i purpurowe guzki średnicy kilku milimetrów o wzmożonej spoistości (ryc. 1). Pierwszym objawem klinicznym był pojedynczy ciemnopurpurowy guzek na rumieniowym podłożu średnicy ok. 1 cm, początkowo pokryty strupem (ryc. 2). Badanie dermoskopowe guzka wykazało szaroczerwone zabarwienie, obszary ze wzorem tęczy oraz łuszczącą się powierzchnią (ryc. 3). Poza tym stwierdzono ciastowate obrzęki obu podudzi. W obrębie węzłów chłonnych dostępnych w badaniu przedmiotowym nie wykazano limfadenopatii.
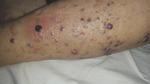
Ryc. 1. Liczne purpurowe i sinoczerwone grudki oraz guzki mięsaka Kaposiego w obrębie podudzia lewego.
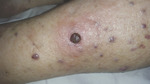
Ryc. 2. Pierwsza zmiana o charakterze ciemnopurpurowego guzka na rumieniowym podłożu średnicy ok. 1 cm.
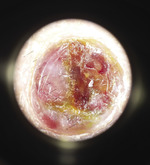
Ryc. 3. Dermoskopowy obraz postaci guzkowej mięsaka Kaposiego przedstawiający bezstrukturalne szarawoniebieskie i czerwone obszary, wzorzec tęczy oraz złuszczanie na powierzchni zmiany (powiększenie x 10).
W badaniach laboratoryjnych z odchyleń stwierdzono podwyższone wartości parametrów stanu zapalnego oraz nieznacznie zwiększoną aktywność dehydrogenazy mleczanowej. Ze względu na brak przesłanek klinicznych i brak zgody pacjentki odstąpiono od badania w kierunku obecności HIV. Wykonane USG Doppler żył głębokich kończyn dolnych wykluczyło zakrzepicę. W tomografii komputerowej lewej kończyny dolnej wykazano znaczny wysięk w jamie stawu kolanowego oraz obrzęk chłonny podudzia, z płynem zlokalizowanym głównie nadpowięziowo. Przeprowadzone badania obrazowe: RTG klatki piersiowej oraz ultrasonografia jamy brzusznej, nie wykazały obecności zmian ogniskowych. Na podstawie badania histopatologicznego jednej ze zmian skórnych przedstawiającego liczne figury podziałów mitotycznych, w tym atypowe (ryc. 4) i dodatniego barwienia immunohistochemicznego na czynniki VIII, CD31 (ryc. 5) i CD34 (ryc. 6) rozpoznano guzkową postać mięsaka Kaposiego (nodular-stage Kaposi sarcoma). W związku z dużą aktywnością mitotyczną (Ki67 w 40 proc. komórek) nie można było wykluczyć postaci agresywnej lub transformacji do mięsaka naczyniowego (angiosarcoma). Chorą skierowano na dalsze leczenie w Centrum Onkologii.
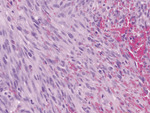
Ryc. 4. Obraz histopatologiczny guzka mięsaka Kaposiego. Liczne figury podziałów mitotycznych, w tym atypowe (barwienie: H-E, obiektyw powiększenie x 40).
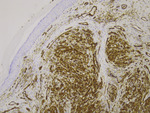
Ryc. 5. Widoczne markery komórek śródbłonka CD31 (obiektyw powiększenie x 10, barwienie immunohistochemiczne).
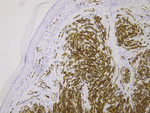
Ryc. 6. Widoczne markery komórek śródbłonka CD34 (obiektyw powiększenie x 10, barwienie immunohistochemiczne).
Artykuł ukazał się

Czasopismo
Dermatologia po Dyplomie











