Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Dążymy do celu
Rak gruczołu krokowego oporny na kastrację
Lek. Bartosz Itrych1
Dr hab. med. Wojciech Majewski2
Dr n. med. Wojciech Rogowski1
Rak gruczołu krokowego (RGK) jest jednym z najczęściej występujących nowotworów złośliwych mężczyzn w Europie. Według danych epidemiologicznych jest drugim po raku płuca nowotworem występującym w Polsce u mężczyzn, według Krajowego Rejestru Nowotworów w 2011 roku w Polsce zarejestrowano 10 318 zachorowań na raka gruczołu krokowego (standaryzowany współczynnik zachorowalności – 35,1/100 000/rok) i 4085 zgonów (standaryzowany współczynnik umieralności – 12,5/100 000/ rok).[1]
Rak gruczołu krokowego najczęściej występuje po 65. r.ż. Uważa się, że do czynników zwiększających ryzyko zachorowania należą:
- wiek (zmiana statusu hormonalnego – przewaga estrogenów),
- rasa czarna,
- czynniki genetyczne (wystąpienie zachorowania wśród krewnych I stopnia zwiększa kilkukrotnie ryzyko zachorowania),
- czynniki środowiskowe.
Najczęściej występującą postacią raka gruczołu krokowego jest rak gruczołowy. Złośliwość RGK określa się według skali Gleasona (Gleason score – Gl.s.). W raku stercza opornym na kastrację standardowym postępowaniem po niepowodzeniu leczenia docetakselem jest obecnie stosowanie octanu abirateronu w drugiej linii leczenia paliatywnego.
Hormonoterapia stanowi leczenie pierwszego wyboru. Znajomość mechanizmów zaangażowanych w rozwój hormonoopornego raka gruczołu krokowego (castration-resistant prostate cancer – CRPC) jest nadal niewystarczająca.[2,3] Rearanżację przekazu sygnału w prawidłowym receptorze uważa się za podstawę patogenezy hormonoopornego raka gruczołu krokowego.[4] W przekaźnictwie sygnałowym androgenów uczestniczą dwa mechanizmy krzyżujące się ze sobą: zależne od receptora androgenowego i niezależne od receptora androgenowego.
Niezależne mechanizmy receptora androgenowego mogą być związane z deregulacją apoptozy poprzez deregulację onkogenów. Wysoki poziom ekspresji bcl-2 stwierdzany jest z większą częstością podczas progresji raka gruczołu krokowego. Regulacja integralności mikrotubul może stanowić mechanizm, poprzez który bcl-2 indukuje swój efekt antyapoptotyczny.[5,6] Niektóre leki, które są aktywne w raku gruczołu krokowego, wywierają efekt poprzez blokowanie tworzenia się mikrotubul. W raku gruczołu krokowego stwierdza się również mutację genu supresorowego p53. Nadekspresja bcl-2, jak również genu supresorowego p53 w materiale tkankowym po prostatektomii, może być czynnikiem predykcyjnym agresywnego przebiegu choroby.[7,8] Obecnie prowadzi się badania kliniczne w zakresie blokowania szlaku sygnałowego bcl-2.[9]
Mechanizmy zależne od receptora estrogenowego stanowią główny szlak progresji raka gruczołu krokowego. Aktywacja receptora androgenowego zależna od liganda stanowi przedmiot badań klinicznych, przykładem może być aktywacja szlaku kinazy tyrozynowej przy stymulacji czynnikiem wzrostu nabłonka (epidermal growth factor – EGF), insulinopodobnego czynnika wzrostu (insulin-like growth factor-1), czynnikiem wzrostu keratynocytów (keratinocyte growth factor). Czynnik wzrostu nabłonka jest potencjalnym mitogenem dla podścieliska i komórek nabłonkowych gruczołu krokowego oraz odgrywa rolę parakrynnego stymulatora.
W guzach niezależnych od receptora androgenowego stymulacja autokrynna odgrywa istotną rolę i prowokuje nieregulowany wzrost guza. Amplifikacja i nadekspresja receptora androgenowego są obserwowane w mniej więcej jednej trzeciej tkankowych materiałów pooperacyjnych i mogą prowadzić do nadwrażliwości receptora androgenowego.[10-12] Mutacje w jego obrębie mogą prowadzić do zmiany przekaźnictwa sygnałowego.[13,14] Jednocześnie występuje wewnątrzkomórkowy wzrost androgenów w wyniku konwersji in situ.[15] Wzrost może być wtórny do wzrostu enzymów zaangażowanych w syntezę wewnątrzkomórkową androgenów. Mutacje receptorów spotykane są jedynie w subpopulacji komórek nowotworowych, w związku z tym jest mało prawdopodobne, by były one odpowiedzialne za całe spektrum mechanizmów androgenoniezależnych.[16]
Definicję nawrotu raka gruczołu krokowego opornego na kastrację (castrate-resistant prostate cancer – CRPC) przedstawiono w tabeli 1.
Stężenie swoistego antygenu gruczołu krokowego jako marker odpowiedzi na leczenie
Wiele badań klinicznych wykorzystuje stężenie swoistego antygenu gruczołu krokowego (prostate specific antigen – PSA) jako marker odpowiedzi na leczenie, mimo że brak jest ustalonych standardów w zakresie stężenia PSA, jak również czasu trwania spadku stężenia antygenu swoistego gruczołu krokowego.[17,18] Pomimo że stężenie PSA wykorzystywane jest jako szybkie narzędzie do oceny aktywności nowych cząsteczek, istnieją sprzeczne dowody na temat roli PSA jako surogatu markera. Badania kliniczne dotyczące szczepionki sipuleucel-T[20,21] wykazały korzyść znamienną statystycznie w zakresie czasu przeżycia całkowitego (overall survival – OS) bez zmiany w zakresie PSA, prowokując pytania dotyczące wartości PSA w zakresie oceny skuteczności leczenia dla leków niehormonalnych i niecytotoksycznych.[22]
W dodatku obserwuje się szerokie fluktuacje stężenia PSA podczas przemijającego efektu działania leków. Aby ocenić efekt działania leków na ekspresję PSA, wskazana jest łączna interpretacja wszystkich danych klinicznych.[23-30] Wykazano, że uzyskanie regresji stężenia PSA > 50 proc. w kolejnych badaniach kontrolnych po leczeniu cytotoksycznym wiąże się ze znamiennie statystyczną poprawą w zakresie przeżyć całkowitych.[31,32] W badaniu klinicznym TAX 327 wykazano, że potwierdzona odpowiedź biochemiczna była związana z wydłużeniem czasu przeżycia całkowitego – średnia czasu przeżycia wynosiła 33 miesiące, kiedy stężenie PSA uległo normalizacji, tj. < 4 ng/ml w porównaniu z czasem przeżycia 15,8 miesiąca dla stężenia PSA powyżej norm referencyjnych.[33,34]
Uważa się, że ilość krążących komórek nowotworowych (circulating tumour cell – CTC) wiąże się z czasem przeżycia całkowitego[35-37] i może stać się surogatem markera dla przeżycia całkowitego, jeśli prospektywne badania kliniczne ustalą ich wartość. Wśród pacjentów z objawowymi przerzutami do kości parametr bólu, a właściwie redukcja poziomu bólu lub całkowite ustąpienie dolegliwości mogą być wykorzystywane w celu oceny skuteczności paliatywnej leczenia.[38] W analizie badania klinicznego TAX 327 odpowiedź biochemiczna PSA oraz odpowiedź w zakresie bólu były ściśle związane z przeżyciem.[39]
Możliwości leczenia
W hormonalnym leczeniu przeciwnowotworowym wykorzystuje się różne mechanizmy działania. Zaliczamy do nich ablację – supresję czynności gonad, kastrację chirurgiczną lub farmakologiczną oraz działanie antagonistyczne – antyandrogeny. Powyższe działanie prowadzi do zmniejszenia produkcji (kastracja chirurgiczna lub farmakologiczna) lub ograniczenia wpływu działania hormonów na komórki nowotworowe. Leczenie ablacyjne skutkuje obniżeniem stężenia testosteronu do wartości kastracyjnych, tj. < 50 ng/ml.
Pomimo kastracji u mężczyzn z rozpoznaniem raka gruczołu krokowego dochodzi do progresji choroby. W tej sytuacji kontynuacja leczenia powodującego supresję androgenów jest kontrowersyjna według Manni i wsp.[40]
W dwóch badaniach klinicznych podjęto próbę oceny, wykazując jedynie marginalną korzyść w zakresie przeżyć całkowitych, wśród pacjentów otrzymujących analogi LHRH (gonadotropin-releasing hormone analogues – aGnRH) w trakcie kolejnych linii leczenia.[41,42]
Wobec braku dostępnych prospektywnych badań klinicznych niewielka potencjalna korzyść z kontynuacji leczenia analogami LHRH przewyższa minimalne ryzyko leczenia. Ponadto w badaniach klinicznych oceniających kolejne linie leczenia stosowano w kontynuacji leczenie analogami LHRH, dlatego uważa się, że obecnie powinno być ono kontynuowane.
Metody ablacyjne stosowane są samodzielnie lub w połączeniu z lekami o działaniu antagonistycznym. Łączne stosowanie metod nosi nazwę maksymalnej blokady androgenowej (maximal androgen blockade – MAB), jednakże wspomniane postępowanie jest dyskusyjne. Wyjątkiem jest zastosowanie maksymalnej blokady androgenowej w celu uniknięcia zespołu zaostrzenia (tumor flare).
Kolejne linie leczenia hormonalnego
Obecnie dostępne w Polsce leki o działaniu hormonalnym wykorzystywane do leczenia raka gruczołu krokowego wymieniono w tabeli 2.
W leczeniu raka gruczołu krokowego stosuje się leki o różnym działaniu hormonalnym. Manipulacje w obrębie leczenia hormonalnego w zakresie kolejnych linii leczenia pozostają nadal w praktyce klinicznej pomimo braku dowodów, że ich stosowanie przynosi korzyść w zakresie przeżywalności. Z obserwacji klinicznych autora część pacjentów z rozpoznanym rakiem gruczołu krokowego w wieku > 60. r.ż. uzyskuje wielomiesięczną korzyść terapeutyczną w zakresie odpowiedzi biochemicznej, przy zastosowaniu całkowitej blokady androgenowej, jak również podczas stosowania wielokrotnych rotacji w obrębie dostępnych leków z grupy antyandrogenów.
Wśród leków o działaniu hormonalnym znajdują się cząsteczki wykazujące działanie antyandrogenne. Do nich należą: bikalutamid, flutamid, enzalutamid. Dawka bikalutamidu koreluje z odpowiedzią biochemiczną. Im wyższa dawka, tym głębsza regresja stężenia PSA.[43] W największej, dotychczas przebadanej grupie chorych z rozpoznaniem raka gruczołu krokowego opornego na kastrację, stanowiącej 52 chorych, wykazano skuteczność dawki dobowej 150 mg bikalutamidu.[44] Wykazano odpowiedź biochemiczną sięgającą 20 proc., nie wykazano efektu paliatywnego. Dołączenie analogu LHRH w momencie progresji biochemicznej choroby skutkowało obniżeniem stężenia PSA tylko u niektórych chorych.[45,46]
Antagonista LHRH – degareliks – wykorzystywany jest u chorych z zaawansowanym nowotworem, u których wskazane jest szybkie obniżenie stężenia testosteronu do stężenia kastracyjnego w związku z wysokim ryzykiem istotnych klinicznie powikłań, takich jak nasilony ból kostny lub zastój moczu w górnych drogach moczowych. Warto zwrócić uwagę na fakt, iż wyłączenie antyandrogenu z leczenia wśród pacjentów uprzednio otrzymujących całkowitą blokadę androgenową wiązało się u ok. 30 proc. pacjentów z odpowiedzią biochemiczną – regresją PSA.[47-52] W badaniu klinicznym SWOG 9426, pomimo całkowitej blokady androgenowej, progresję biochemiczną odnotowano u 210 pacjentów z cechą M0 lub M1.[53] Wyniki wybranych badań klinicznych III fazy przedstawiono w tabeli 3.

Tabela 3. Wybrane badania kliniczne III fazy w grupie chorych z rozpoznaniem raka gruczołu krokowego opornego na kastrację: stopień regresji stężenia PSA, bólu, przeżycia całkowite, czas do progresji.
Wykazano również odpowiedź biochemiczną u 21 proc. pacjentów przy braku odpowiedzi radiologicznej. Średni czas do progresji choroby (progression free survival – PFS) wynosił trzy miesiące. Wśród 19 proc. pacjentów z cechą M0 średni czas do progresji choroby sięgał powyżej 12 miesięcy. Czas do progresji choroby, jak również czas przeżycia całkowitego koreluje z okresem stosowania niesteroidowych leków o działaniu hormonalnym, niższym wyjściowym stężeniem PSA oraz cechą M0.
Rak gruczołu krokowego w modelach zwierzęcych wykazuje ekspresję receptorów estrogenowych, których ekspresja wzrasta po zastosowaniu leczenia kastracyjnego. Dietylostylbestrol (diethylstilboestrol – DES)[54,55] wykazuje odpowiedź biochemiczną sięgającą 24 i 80 proc. z przybliżonym czasem przeżycia całkowitego rzędu 63 proc. w okresie dwóch lat. Jednakże, nawet przy zastosowaniu niskich dawek dietylostylbestrolu, w mniej więcej 31 proc. przypadków stwierdzono zakrzepicę żył głębokich i w mniej więcej 7 proc. zawał mięśnia sercowego.
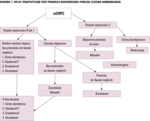
Opcje terapeutyczne przy progresji biochemicznej podczas leczenia hormonalnego przedstawia schemat 1. Korzyść terapeutyczną wielu nowoczesnych leków o działaniu hormonalnym oceniano po zastosowaniu chemioterapii, tj. po leczeniu docetakselem, za wyjątkiem octanu abirateronu oraz enzalutamidu, które również oceniono przed leczeniem docetakselem. Wyniki wybranych badań klinicznych III fazy przedstawiono w tabeli 4.

Tabela 4. Wybrane randomizowane badania kliniczne III fazy w grupie chorych z rozpoznaniem raka gruczołu krokowego opornego na kastrację.
Octan abirateronu wybiórczo hamuje aktywność enzymu CYP17 (o aktywności 17α-hydroksylazy i C17,20-liazy). Enzym ten odpowiedzialny jest za biosyntezę androgenów w jądrach, nadnerczach i tkance nowotworowej gruczołu krokowego. Zablokowanie jego aktywności prowadzi do wstrzymania produkcji testosteronu. Hamowanie CYP17 skutkuje również zwiększoną produkcją mineralokortykoidów w nadnerczach. W prospektywnym kontrolowanym placebo badaniu klinicznym III fazy z randomizacją (COU-AA-301) zastosowano octan abirateronu w skojarzeniu z prednizonem wśród chorych z rozpoznaniem raka gruczołu krokowego opornego na kastrację, po uprzednim niepowodzeniu leczenia docetakselem. Wykazano znamiennie statystyczną korzyść terapeutyczną – średni czas przeżycia całkowitego 11,2 miesiąca (95% CI 10,4-13,1 miesiąca) w porównaniu z 15,8 miesiąca (95% CI 14,8-17,0 miesiąca) w ramieniu z octanem abirateronu. Mediana czasu obserwacji wynosiła 20,2 miesiąca. Wykazano również wydłużenie mediany czasu do progresji PSA (8,5 miesiąca [95% CI 8,3-11,1] wobec 6,6 miesiąca [95% CI 5,6-8,3]; HR 0,63; p < 0,0001).
W prospektywnym kontrolowanym placebo badaniu klinicznym III fazy z randomizacją (COU-AA-302) zastosowano octan abirateronu w skojarzeniu z prednizonem wśród chorych z rozpoznaniem raka gruczołu krokowego opornego na kastrację, bez uprzedniego leczenia docetakselem. Wykazano wydłużenie mediany czasu przeżycia całkowitego o 4,8 miesiąca (35,3 v. 30,1 miesiąca; HR 0,79, p = 0,0151). Leczenie octanem abirateronu zmniejszyło również ryzyko progresji radiograficznej (radiographic progression free survival – rPFS) lub zgonu o 47 proc. w porównaniu z placebo (HR = 0,53; 95% CI: 0,451; 0,623; p < 0,0001). Mediana rPFS wyniosła 16,5 miesiąca w ramieniu z octanem abirateronu i 8,3 miesiąca w grupie z placebo.[56-58]
Docetaksel jest lekiem przeciwnowotworowym, działającym poprzez pobudzanie łączenia tubuliny w trwałe mikrotubule i hamowanie ich rozpadu, co powoduje znaczne zmniejszenie ilości wolnej tubuliny. Łączenie docetakselu z mikrotubulami nie zmienia liczby protofilamentów. Bezpieczeństwo i skuteczność docetakselu w skojarzeniu z prednizonem i prednizolonem u pacjentów z hormononiezależnym rakiem gruczołu krokowego oceniano w wieloośrodkowym randomizowanym badaniu III fazy TAX 327. Do badania włączono łącznie 1006 pacjentów z KPS ≥ 60 i przydzielono losowo do grup o następujących schematach leczenia:
A. Docetaksel 75 mg/m2 pc. co 3 tygodnie przez 10 cykli.
B. Docetaksel 30 mg/m2 pc. podawany co tydzień przez pierwsze 5 tygodni, w 6-tygodniowym cyklu, przez 5 cykli.
C. Mitoksantron 12 mg/m2 pc. co 3 tygodnie przez 10 cykli.
Mediana czasu przeżycia wyniosła 18,9 miesiąca względem 16,6 miesiąca w grupie leczonej mitoksantronem (HR = 0,7695%; CI 17,0-21,2).[59-62]
Kabazytaksel jest lekiem przeciwnowotworowym nowszej generacji, działającym przez zakłócenie sieci połączeń mikrotubul w komórkach. Kabazytaksel wiąże się z tubuliną i pobudza proces odkładania się tubuliny do mikrotubul, hamując równocześnie ich rozpad. Prowadzi to do stabilizacji mikrotubul, co powoduje zahamowanie mitotycznych i interfazowych podziałów komórki. Skuteczność i bezpieczeństwo stosowania powyższego leku w skojarzeniu z prednizonem lub prednizolonem oceniano w międzynarodowym, wieloośrodkowym badaniu III fazy – TROPIC. Całkowite przeżycie było znamiennie dłuższe u pacjentów przyjmujących kabazytaksel w porównaniu z mitoksantronem (odpowiednio 15,1 v. 12,7 miesiąca), z 30-proc. zmniejszeniem ryzyka zgonu w porównaniu z mitoksantronem.[63,64]
Enzalutamid jest wskazany w leczeniu opornego na kastrację raka gruczołu krokowego z przerzutami u mężczyzn, u których podczas lub po zakończeniu leczenia docetakselem nastąpiła progresja choroby. Jest silnym inhibitorem przekazywania sygnałów przez receptor androgenowy. Blokuje on kilka etapów szlaku przekazywania sygnałów przez receptor androgenowy: kompetytywnie blokuje wiązanie się androgenów z receptorem androgenowym, blokuje przemieszczenie aktywnego receptora do jądra oraz wiązanie aktywnego receptora androgenowego z DNA, nawet w przypadku nadekspresji receptorów androgenowych oraz w raku gruczołu krokowego opornym na leczenie antyandrogenami.
Skuteczność i bezpieczeństwo powyższego leku oceniano w randomizowanym kontrolowanym placebo, wieloośrodkowym badaniu klinicznym III fazy, wśród pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami, leczonych uprzednio docetakselem. Chorzy stosowali równolegle analog hormonu uwalniającego gonadotropinę (gonadotropin-releasing hormone – GnRH) lub byli poddani kastracji chirurgicznej (orchidektomii). Całkowitą liczbę 1199 pacjentów zrandomizowano w stosunku 2:1 do dwóch grup, otrzymujących odpowiednio doustnie enzalutamid w dawce 160 mg raz na dobę (N = 800) lub placebo raz na dobę (N = 399). Pacjentom pozwolono na dobrowolne przyjmowanie prednizonu (maksymalna dozwolona dawka dobowa wynosiła 10 mg prednizonu lub jego odpowiednika). Czas przeżycia bez progresji potwierdzony oceną radiologiczną oceniony przez badaczy za pomocą kryteriów RECIST, wersja 1,1 (Response Evaluation Criteria In Solid Tumors) wynosił 8,3 miesiąca dla pacjentów leczonych enzalutamidem oraz 2,9 miesiąca dla pacjentów otrzymujących placebo (HR = 0,404, 95% CI [0,350; 0,466]); p < 0,0001). Całkowity czas przeżycia pacjentów leczonych enzalutamidem lub placebo przedstawiono w tabeli 5.
Podsumowanie
W ostatnich latach obserwuje się wzrost zainteresowania leczeniem systemowym chorych na raka gruczołu krokowego opornego na kastrację. W leczeniu tych chorych wskazane jest postępowanie multidyscyplinarne. Opieka nad chorym z rozpoznaniem raka gruczołu krokowego w stadium oporności na kastrację stanowi ogromne wyzwanie dla ówczesnej onkologii. Pomimo toczących się badań klinicznych nowych cząsteczek oraz nowych rejestracji leków już dostępnych do leczenia w praktyce klinicznej nie wszystkie obecnie zarejestrowane cząsteczki dostępne są w praktyce klinicznej w Polsce. Aktualnie wykorzystywane są docetaksel i octan abirateronu. Kabazytaksel (nowy chemioterapeutyk z grupy taksoidów) z uwagi na negatywną opinię Agencji Oceny Technologii Medycznych i Taryfikacji (AOTMiT) nie jest stosowany w Polsce.