Strukturalne choroby serca i kardiomiopatie
Tachykardiomiopatia
Artur Filipecki
Wprowadzenie
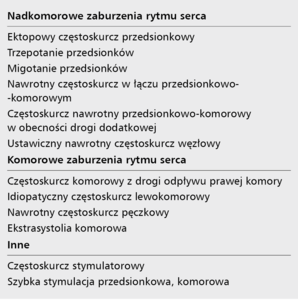
Tachykardiomiopatia (tachycardia induced cardiomyopathy, TIC) jest zaburzeniem funkcji i budowy serca wywołanym szybką czynnością serca w przebiegu komorowych lub nadkomorowych, ustawicznych lub często nawracających zaburzeń rytmu serca. Definicja kardiomiopatii Europejskiego Towarzystwa Kardiologicznego wyklucza procesy i zaburzenia będące konsekwencją uszkodzenia zastawek, nadciśnienia czy choroby niedokrwiennej serca [1-3]. TIC wyróżniono jako rodzaj nabytej kardiomiopatii rozstrzeniowej, którą rozpoznaje się po wykluczeniu innej przyczyny, potwierdzając ją poprawą czynności skurczowej serca po opanowaniu arytmii. Za wartości graniczne potwierdzające rozpoznanie przyjmuje się wzrost frakcji wyrzutowej lewej komory o ≥10%, do wartości ≥45% [4]. Większość doniesień dotyczących TIC opisuje pojedyncze przypadki lub nieduże grupy chorych. Zarówno przypadki kliniczne, jak i badania eksperymentalne wskazują, że dysfunkcja mięśnia sercowego związana jest z wystąpieniem i utrzymywaniem się szybkiej czynności serca w postaci różnych nadkomorowych lub komorowych zaburzeń rytmu serca (tab. 1). Do TIC zalicza się także zaburzenia funkcji mięśnia sercowego w przebiegu licznej ekstrasystoli komorowej, zwykle w postaci bi- lub trigeminii, najczęściej stanowiącej >20% zapisu wielogodzinnego monitorowania EKG metodą Holtera.
TIC występuje w każdej grupie wiekowej: opisano jej przypadki u płodów (24-33 tydzień), u niemowląt, dzieci, młodzieży i dorosłych [5-7]. W młodszych grupach wiekowych TIC może rozwinąć się na podłożu częstoskurczów powstających jako konsekwencja operacyjnego leczenia wad wrodzonych serca. U dorosłych, zwłaszcza u osób starszych, główną przyczyną jest migotanie przedsionków. TIC wydaje się niedocenianą przyczyną niewydolności serca: uważa się, że u 25-50% chorych z migotaniem przedsionków i niewydolnością serca tachykardia jest istotną przyczyną objawów [8,9]. Do końca nie można określić, którzy pacjenci z tachyarytmią rozwiną niewydolność lewokomorową. Uważa się, że czynnikami ryzyka rozwoju TIC są: rodzaj zaburzeń rytmu serca, wiek, utrzymywanie się częstości rytmu serca >100/min, długość trwania tachyarytmii, leki, obecność współistniejącej choroby serca i choroby towarzyszące.
Mechanizm TIC
Badania doświadczalne wykazują, że szybka stymulacja serca (zarówno na poziomie przedsionków, jak i komór) zwiększa ciśnienie napełniania komór (lewej i prawej), zmniejsza kurczliwość i rzut serca [8,10]. Zmiany neurohumoralne są podobne do stwierdzanych w kardiomiopatii rozstrzeniowej i obejmują aktywację układu współczulnego, zwiększenie stężenia przedsionkowego czynnika natriuretycznego, aktywację osi renina-aldosteron.
Morfologicznie stwierdza się poszerzenie jam serca bez zwiększenia grubości ścian czy masy serca. Na poziomie komórkowym dochodzi do zmniejszenia liczby komórek mięśniowych, ich wydłużenia oraz zwiększenia ilości macierzy zewnątrzkomórkowej. Dochodzi także do wyczerpania zasobów związków wysokoenergetycznych (ATP, fosfokreatyny, kreatyny), wzrostu aktywności oksydaz cyklu Krebsa, uszkodzenia mitochondriów, zmniejszenia gęstości receptorów beta-adrenergicznych i zaburzeń gospodarki wapniowej. Postuluje się udział niedokrwienia w powstawaniu zmian. Efekt szybkich rytmów następuje z opóźnieniem, po pewnym czasie trwania tachyarytmii.
Rozpoznanie
Stwierdzenie objawów niewydolności serca, dysfunkcji lewej komory i ustawicznej szybkiej akcji serca (zwykle powyżej 100 uderzeń na minutę) powinno zwrócić naszą uwagę na możliwość TIC i należy uwzględnić ją w różnicowaniu. Według Fenelona kryteriami rozpoznania są rozstrzeń i cechy niewydolności serca przy tachyarytmii utrzymującej się przez ponad 10-15% doby z częstością akcji przedsionków >150% przewidywanej wartości w danej grupie wiekowej [8]. Często rozpoznanie potwierdza się wstecznie po stwierdzeniu poprawy lub powrotu do normy upośledzonej funkcji lewej komory po wyeliminowaniu arytmii lub zwolnieniu rytmu serca. W części przypadków zmiany nie są w pełni odwracalne, zwłaszcza jeśli TIC współistnieje na przykład z idiopatyczną kardiomiopatią rozstrzeniową. Badania obrazowe, takie jak echokardiografia, badanie radioizotopowe, koronarografia czy coraz szerzej stosowany rezonans magnetyczny, potwierdzają zaburzenia funkcji serca i pozwalają wykryć lub wykluczyć choroby współistniejące. Diagnostyka elektrokardiograficzna, w tym ambulatoryjne monitorowanie EKG, jest podstawą w określeniu typu arytmii. U niektórych chorych z utrwaloną tachyarytmią spoczynkowa czynność serca nie jest wysoka, ale odpowiadają oni dużymi przyspieszeniami na mały wysiłek, co można potwierdzić w trakcie próby wysiłkowej. Ambulatoryjne monitorowanie EKG metodą Holtera, telemetria i próba wysiłkowa pozwalają także na ocenę wyników leczenia.
W różnicowaniu należy uwzględnić inne odwracalne postacie kardiomiopatii spowodowane chorobą niedokrwienną serca, nadciśnieniem, zapaleniem mięśnia sercowego, nadużywaniem alkoholu, posocznicą, a także kardiomiopatie po zatrzymaniu krążenia czy kardiowersji oraz kardiomiopatię okołoporodową i zespół tako-tsubo. Migotanie przedsionków jest najczęstszą arytmią u chorych z idiopatyczną kardiomiopatią rozstrzeniową. Istnieją dowody, że kryterium różnicującym mogą być mniejsze wymiary lewej komory (wymiar końcowo-rozkurczowy ≤66 mm) w TIC, co wiąże się z krótszym czasem powstania dysfunkcji lewej komory [11].
Leczenie
Wyeliminowanie tachyarytmii przez przerwanie i zapobieganie nawrotom zaburzeń rytmu lub kontrolę częstości akcji serca można osiągnąć za pomocą leków lub metod niefarmakologicznych [12-17].
W doraźnym zwolnieniu rytmu serca stosuje się leki beta-adrenolityczne, antagonistów kanałów wapniowych (werapamil, diltiazem), digoksynę (zwłaszcza w ektopowym częstoskurczu przedsionkowym [ectopic atrial tachycardia, EAT]). W poszczególnych rodzajach arytmii napad częstoskurczu można przerwać swoistą terapią, na przykład w częstoskurczu nawrotnym w łączu przedsionkowo-komorowym po wypróbowaniu manewrów zwiększających napięcie nerwu błędnego lekiem z wyboru jest adenozyna. W przypadku niestabilnych hemodynamicznie chorych postępowaniem z wyboru jest kardiowersja elektryczna.
Leczenie przewlekłe
Nawrotom arytmii można zapobiegać, stosując leki beta-adrenolityczne lub antyarytmiczne klasy I według Vaugham-Williamsa, np. antagonistów kanału sodowego, takich jak propafenon, pamiętając o ich ujemnym inotropowo wpływie. U osób z małą frakcją wyrzutową lewej komory, a także w komorowych zaburzeniach rytmu serca preferowanym lekiem jest amiodaron, który daje dużo działań niepożądanych, zwłaszcza przy długim okresie terapii.
U chorych z utrwalonym migotaniem przedsionków skuteczną kontrolę rytmu można osiągnąć, stosując leki zwalniające przewodzenie w łączu przedsionkowo-komorowym, takie jak: beta-adrenolityki, werapamil, digoksyna, w monoterapii lub w połączeniach, wykorzystując maksymalne tolerowane dawki. Za skuteczną kontrolę rytmu do niedawna uważano czynność serca <80 uderzeń na minutę w spoczynku i <110 na minutę w czasie umiarkowanego wysiłku. Najnowsze europejskie wytyczne leczenia migotania przedsionków liberalizują te wartości do utrzymywania rytmu w spoczynku poniżej 110 uderzeń na minutę. U chorych z TIC należy kierować się klinicznym wynikiem zwolnienia rytmu serca.
Leczenie niefarmakologiczne

Tabela 2. Zastosowanie przezskórnej ablacji w leczeniu najczęstszych zaburzeń rytmu serca prowadzących do rozwoju tachykardiomiopatii
Obecnie preferowaną metodą definitywnego wyleczenia jest przezskórna ablacja podłoża arytmii różnymi technikami dostarczania energii (prąd o częstotliwości radiowej, zamrażanie, energia mikrofalowa – tab. 2). Zabieg klasyczny lub z wykorzystaniem systemów mapowania elektrofizjologicznego jest skuteczny w 80-98% przypadków trzepotania przedsionków, częstoskurczu nawrotnego w łączu przedsionkowo-komorowym czy częstoskurczu przedsionkowo-komorowego z udziałem drogi dodatkowej, czyli tam, gdzie anatomiczne podłoże zaburzeń rytmu jest łatwe do zlokalizowania. W przypadku chorych z migotaniem przedsionków ablacja okrążająca żyły płucne jest obecnie coraz powszechniej stosowana. Preferuje się ją zwłaszcza u chorych z napadową arytmią i nieznacznie poszerzonym lewym przedsionkiem, czyli w przypadku krócej trwającej choroby, z mniejszym uszkodzeniem strukturalnym serca, kiedy spodziewać się można dużej skuteczności – powyżej 75%. W przetrwałym migotaniu przedsionków należy liczyć się z mniejszą skutecznością ablacji i koniecznością postępowania kilkuetapowego: poza izolacją żył płucnych, potrzebne może być wykonanie dodatkowych linii ablacyjnych w lewym i prawym przedsionku, usunięcie potencjałów fragmentowanych i ablacja zwojów nerwowych w jednej lub kilku sesjach. U chorych, u których intensywną farmakoterapią nie udaje się uzyskać kontroli częstości rytmu i nie można zniszczyć substratu arytmii, w ostateczności można wykonać ablację łącza przedsionkowo-komorowego po uprzednim wszczepieniu stymulatora serca na stałe. Ze względu na całkowitą zależność od stymulacji prawokomorowej istotnie pogarszającej funkcję lewej komory po tym okaleczającym zabiegu, należy rozpatrzyć wszczepienie systemu resynchronizującego (stymulacja dwukomorowa).
W przypadku komorowych zaburzeń rytmu serca zabiegi ablacji są skuteczne u 80-90% chorych. Dotyczy to pacjentów zarówno z częstoskurczami (ogniskowe z drogi odpływu prawej i lewej komory, pęczkowe lewokomorowe), jak i licznymi pojedynczymi skurczami komorowymi (ogniskowe z drogi odpływu prawej i lewej komory).