Chrońmy antybiotyki
Przeciwzapalne efekty 1,8-cyneolu w przebiegu infekcji dróg oddechowych
Infekcje wirusowe wymagają przede wszystkim leczenia przeciwzapalnego, które jednocześnie łagodzi objawy choroby. Dysponujemy coraz liczniejszą grupą substancji spoza grupy niesteroidowych leków przeciwzapalnych (NLPZ), które mają sprawdzoną, wysoką skuteczność w omawianych schorzeniach
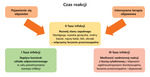
Pacjenci z infekcyjnymi chorobami dróg oddechowych, niezależnie od typu wywołującego je patogenu (wirus, bakteria, grzyb), stanowią największą grupę chorych w gabinecie lekarza, porównywalną liczebnością jedynie z grupą pacjentów cierpiących z powodu bólu. Z tego względu infekcyjne choroby dróg oddechowych zajmują szczególne miejsce z punktu widzenia zdrowia publicznego, ale również organizacji opieki zdrowotnej, a także wysokich kosztów pośrednich i bezpośrednich związanych z ich występowaniem (odpowiadają za ponad 5% wszystkich nieobecności w pracy w Polsce)1. Infekcja powoduje obronną reakcję immunologiczną organizmu i tak naprawdę powodem zgłoszenia się pacjenta do lekarza nie jest sam fakt infekcji, ale pojawienie się objawów wzmożonej reakcji organizmu (katar, ból głowy, gorączka, kaszel itd.), które jest jej konsekwencją (ryc. 1).
Oznaczanie biomarkerów
Idealną terapią byłoby połączenie leczenia przyczynowego (przeciwwirusowego, przeciwbakteryjnego itd.) z objawowym, czyli szybkim usunięciem dokuczliwych dla pacjenta symptomów choroby. Drugi element jest w pełni realizowalny, ponieważ niezależnie od etiologii zespół objawów w infekcjach dróg oddechowych jest do siebie zbliżony. Z kolei leczenie przyczynowe dostępne jest w przypadku infekcji bakteryjnych, części grzybiczych i tylko niektórych wirusowych. Nie dysponujemy dotychczas skutecznymi lekami przyczynowymi dla znaczącej większości infekcji wirusowych, a to właśnie one odpowiadają za niemal 90% przypadków klinicznych infekcji górnych dróg oddechowych (GDO), a jedynie 2-4% pacjentów wymaga antybiotykoterapii. Nie istnieją niestety bezwzględne parametry różnicujące etiologię zakażenia u danego pacjenta. Jednak połączenie badania przedmiotowego i podmiotowego daje zazwyczaj bardzo istotne wskazówki co do diagnozy, które zostały opisane m.in. w publikacji dotyczącej prawidłowej antybiotykoterapii2.
Zbędne i nadmiarowe stosowanie antybiotyków prowadzi do powstawania i utrwalania się antybiotykooporności (AMR − antimicrobial resistance), jest powodem licznych objawów niepożądanych u pacjentów, a także okresowych spadków odporności oraz zwiększenia ryzyka rozwoju niektórych chorób przewlekłych3. Narastająca oporność bakterii na działanie antybiotyków jest wg Światowej Organizacji Zdrowia jednym z najważniejszych współczesnych problemów ludzkości. Szacuje się, że tylko w Europie każdego roku ponad 30 tys. osób umiera z powodu infekcji wywoływanych przez bakterie lekooporne4.
Zanim uda się upowszechnić (w celu precyzyjnej diagnostyki infekcji) metody oparte np. na technologii amplifikacji kwasów nukleinowych (NAAT − nucleic acid amplification technology) lub identyfikacji profilu białkowego z wykorzystaniem spektrometrii mas (MALDI-TOF MS − matrix-assisted laser desorption/ionization time-of-flight mass spectrometry), narzędziem już dostępnym, choć niewykorzystanym, jest ocena biomarkerów. Każda z reakcji patofizjologicznych, w tym stan zapalny, ma swoje biomarkery, czyli substancje, których stężenie np. w surowicy krwi informuje nas pośrednio o ich przebiegu. Rozwiązaniem potencjalnie atrakcyjnym, np. w kontekście diagnostyki przyczyn infekcji układu oddechowego, jest oznaczenie biomarkerów. Obecnie w praktyce wykorzystywane są: stężenie białka reaktywnego C (CRP − C-reactive protein), prokalcytoniny oraz zdecydowanie rzadziej − stężenie cytokin prozapalnych (np. IL-2, IL-6, IL-8 [IL− interleukina]). Żadne z wymienionych badań nie może być użyte do jednoznacznego różnicowania infekcji wirusowej od bakteryjnej ani do identyfikacji bakterii.
Dotychczasowe obserwacje wskazały, że zastosowanie 1,8-cyneolu u pacjentów z infekcjami górnych dróg oddechowych prowadzi do znacznego zmniejszenia uwalniania mediatorów prozapalnych, takich jak ludzki czynnik martwicy nowotworu (TNF − tumor necrosis factor) TNF-α, IL-1β i IL-6 z monocytów5, a także IL-4 i IL-5 z limfocytów6.
W większości przypadków leczenia objawowego jest to terapia związana z modulowaniem odpowiedzi układu immunologicznego, w zależności od sytuacji klinicznej. Zmniejszając reakcję, terapia równocześnie zmniejsza ilość i natężenie objawów infekcji, co poprawia samopoczucie oraz komfort życia pacjenta (HRQoL – health related quality of life)7. Jednocześnie ulega redukcji ryzyko przejścia organizmu w stan nadmiarowej mobilizacji immunologicznej, uszkadzania własnych tkanek i promocji mechanizmów autoimmunologicznych (ryc. 1). Reakcja odpornościowa jest wieloetapowym, skomplikowanym procesem z wieloma równoległymi ścieżkami częściowo się wzmacniającymi, częściowo wyhamowującymi. Przeważnie jednak zapalenie ma tendencje do autoamplifikacji z jednoczesną słabą kontrolą tego procesu, dlatego stosowanie leków przeciwzapalnych jest korzystne także z punktu widzenia patofizjologii.
Leczenie chorób układu oddechowego substancjami pochodzenia roślinnego
Jedną z możliwych do zastosowania substancji w łagodzeniu objawów omawianych schorzeń jest przeciwzapalny monoterpen 1,8-cyneol (eukaliptol, 1,3,3-trimetylo-2-oksabicyklo [2.2.2] oktan), będący naturalną substancją terapeutyczną pochodzenia roślinnego stosowaną w leczeniu różnych chorób układu oddechowego. Eukaliptol jest pozyskiwany przede wszystkim w trakcie ekstrakcji parowej liści eukaliptusa. Jest to substancja wykazująca się m.in. silnymi właściwościami antymucynowymi (zmniejsza produkcję bogatej w mucynę wydzieliny w drogach oddechowych), a także działaniami: wykrztuśnym (sekretolitycznym – m.in. poprzez redukcję ekspresji genów mucyn MUC2, MUC19) i mukokinetycznym (poprzez stymulację mechanizmu rzęskowego)8,9.
Istotność takiego działania udowodniono w badaniach klinicznych kontrolowanych placebo zarówno w ostrych infekcjach układu oddechowego (ostre zapalanie błon śluzowych nosa i zatok przynosowych, ostre zapalenie oskrzeli), jak i we wspomaganiu przewlekłej terapii chorób obturacyjnych, szczególnie przewlekłej obturacyjnej choroby płuc oraz astmy.
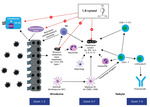
Wspomniane efekty przeciwzapalne działania 1,8-cyneolu są przykładami poliwalentnego wpływu jednej substancji na wieloetapowy proces zapalny (ryc. 2). Badanie Fischera i wsp. (2013) dotyczące ostrego zapalenia oskrzeli pokazuje znaczącą redukcję u pacjentów liczby i nasilenia epizodów kaszlu11, a Kehrla i wsp. (2004) szybką redukcję większości objawów (m.in. zatkania nosa, bólu głowy, ilości śluzu)12, a także bardziej skuteczne działanie w porównaniu z produktem złożonym z substancji czynnych pochodzących z pięciu surowców roślinnych: Gentianae radix, Primulae flos cum calycibus, Ramicis herba, Sambuci fIos, Verbenae herba, Tesche (2008)13. Należy zwrócić uwagę na dwie bardzo istotne publikacje z ostatniego roku. Pokazano w nich, że nie tylko samo zastosowanie 1,8-cyneolu ma wpływ na obniżenie długości trwania i ciężkości infekcji wirusowej GDO, ale istotnym czynnikiem wpływającym na te parametry jest czas wdrożenia leczenia (czas reakcji, ryc. 1). 1,8-cyneol włączony nie później niż 12 godz. po wystąpieniu pierwszych objawów ostrego zapalenia błony śluzowej nosa i zatok przynosowych powodował istotnie krótszy, a także łagodniejszy przebieg infekcji14.
Obserwacja ta doskonale wpisuje się w zasady leczenia przeciwobjawowego oraz współgra z omówionym powyżej faktem, że to objawy, a nie sama infekcja powodują zgłoszenie się pacjenta do lekarza.
Dwa badania, opublikowane w odstępie 25 lat, wskazują na bardzo wysoki potencjał 1,8-cyneolu (nie do końca jeszcze wykorzystywany) w objawowym leczeniu zakażeń wirusowych GDO zarówno przy podaniu drogą wziewną15, jak i doustną16. Nowsze z nich, opublikowane w marcu 2023 r. (wykorzystano w nim chromatografię gazową), udowadnia obecność 1,8-cyneolu w polipach nosa po podaniu doustnym, co dowodzi skuteczności tej drogi podania. Istotne jest również to, że stężenie 1,8-cyneolu nie było zależne ani od wskaźnika masy ciała (BMI – body mass index), ani też od masy ciała.