Pacjent w trakcie leczenia onkologicznego
Stomia – wskazówki praktyczne. Opis przypadku pacjentki z rakiem gruczołowym jelita grubego
dr n. med. Lucyna Pachocka
- Opis przypadku, w którym przeprowadzona metodą Hartmanna operacja u pacjentki dała możliwość odtworzenia ciągłości przewodu pokarmowego, a zmiana nawyków żywieniowych pozwoliła jej powrócić do normalnego życia
- Zasady leczenia dietetycznego pacjenta ze stomią
Stomia, nazywana też przetoką jelitową lub potocznie sztucznym odbytem, jest chirurgicznie wytworzonym połączeniem światła jelita grubego lub cienkiego z powierzchnią ciała, wykonywanym najczęściej na przedniej ścianie brzucha1. Najczęstszymi wskazaniami do wytworzenia przetoki jelitowej są brak możliwości dostarczenia pożywienia drogą naturalną do jelit oraz niemożność oddawania stolca drogą naturalną. Stomię wyłania się w celu wprowadzania substancji odżywczych do światła przewodu pokarmowego (gastrostomia, czyli odżywcza przetoka żołądkowa) lub w celu wytworzenia zastępczej drogi odprowadzenia kału (stomia w obrębie jelita grubego [kolostomia] i cienkiego [ileostomia; jejunostomia]). Odpowiednie umiejscowienie i wykonanie brzusznego odbytu jest jednym z najważniejszych czynników warunkujących jego prawidłowe funkcjonowanie. Do najczęstszych przyczyn wyłaniania stomii należy rak jelita grubego, który jest jednym z najczęściej występujących nowotworów złośliwych i jedną z głównych przyczyn zgonów z powodu raka.
Stwierdzono, że ryzyko wystąpienia raka jelita grubego można zmniejszyć poprzez odpowiednią zmianę diety i stylu życia. Wykazano, że 47% wszystkich zachorowań na raka jelita grubego byłoby możliwych do uniknięcia dzięki zachowaniu właściwego poziomu aktywności fizycznej, utrzymaniu zdrowej masy ciała oraz przestrzeganiu zasad zdrowego żywienia.
Rokowanie w raku jelita grubego zależy od stopnia zaawansowania choroby2,3. Wczesne etapy, bez przerzutów do węzłów chłonnych i nacieków na inne organy wewnętrzne, dają szansę na całkowite wyzdrowienie pacjenta. Dzięki postępowi współczesnej chirurgii i osiągnięciom naukowo-technicznym powrót chorego ze stomią do normalnego życia jest możliwy. Przeprowadzona metodą Hartmanna operacja u opisanej poniżej pacjentki dała możliwość odtworzenia ciągłości przewodu pokarmowego, a zmiana zachowań żywieniowych pozwoliła jej powrócić do normalnego życia.
Opis przypadku
Kobieta w wieku 61 lat z rozpoznaniem guza odbytnicy G1 na zagięciu esiczo-odbytniczym zaciskającym światło jelita z przerzutem do wątroby została poddana leczeniu operacyjnemu z wyłonieniem stomii jelita grubego. Rak naciekał całą grubość ściany jelita grubego, wnikał do tkanki tłuszczowej okołojelitowej. Cech naciekania pni nerwowych nie znaleziono. Dalsze badania wykazały przerzuty raka w 2 z 13 węzłów chłonnych i 10 drobnych polipów. Na podstawie decyzji konsylium kobieta została zakwalifikowana do chemioterapii FOLFOX (oksaliplatyna 120 mg, leukoworyna 280 mg, 5-fluorouracyl 850 mg) we wlewach 22-godzinnych. Przeszła 8 cykli chemioterapii.
Masa ciała pacjentki w momencie pierwszej chemioterapii wynosiła 45 kg przy wzroście 158 cm. Przy wypisie pacjentce zalecono poza leczeniem farmakologicznym (tietylperazyna 6,5 mg 3 ×1 tabl. w razie nudności i wymiotów, flukonazol 100 mg 2 × 1 tabl. w razie zmian w jamie ustnej, loperamid 1-2 tabl. w razie biegunki, cetyryzyna 1 × 1 tabl., metoprolol 50 mg 2 × pół tabl.) stosowanie diety lekkostrawnej i wypijanie około 2,5 litra płynów dziennie.
Po miesiącu od wypisu kobieta zgłosiła się do Poradni Chorób Metabolicznych Instytutu Żywności i Żywienia w celu uzyskania bardziej szczegółowych zaleceń dietetycznych. Masa ciała pacjentki w chwili przyjęcia wyniosła 47 kg (BMI 18,83 kg/m2).
Pacjentce zalecono lekkostrawną dietę wysokobiałkową (20% energii z białka) o zwiększonej o 15-20% wartości energetycznej (tj. 2150-2200 kcal). W razie problemów ze zwiększonym przyjmowaniem produktów spożywczych zaproponowano dodanie doustnych suplementów pokarmowych (ONS – oral nutritional supplements). W celu zapobiegania zaparciom polecono, aby pacjentka nie ograniczała za bardzo błonnika rozpuszczalnego i spożywała codziennie różne warzywa i owoce w takiej formie, jaka będzie przez nią akceptowana. Z diety wykluczono orzechy, nasiona i inne ziarna (dopuszczono je w ograniczonej ilości, ale tylko w postaci mielonej), a także owoce drobnopestkowe, aby nie dopuścić do zatkania stomii.
Z tłuszczów zalecono preferowanie olejów roślinnych będących źródłem kwasów omega-3, a z grupy produktów białkowych – ryby, które także stanowią dobre źródło tych kwasów. Natomiast mięso polecano głównie w postaci gotowanych pulpetów lub posiekane/zmielone w zupie. Zwrócono także uwagę na potrzebę spożywania ok. 2,5 l płynów i stosowanie w przypadku biegunek elektrolitów.
Po roku dokonano dekolostomii sposobem Hartmanna. Przebieg zabiegu i wczesny okres pooperacyjny były niepowikłane. Gojenie ran było prawidłowe, tolerancja diety dobra. Pacjentka została wypisana w stanie dobrym z zaleceniem diety wysokobiałkowej.
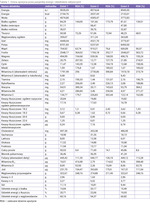
Po 1,5 roku pacjentka zgłosiła się do Poradni Chorób Metabolicznych Centrum Medycznego Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny w celu aktualizacji zaleceń dietetycznych. Masa ciała kobiety w dniu przyjęcia wynosiła 61 kg (BMI 24,4 kg/m2). Poproszono ją o zapisanie jadłospisu z 3 dni, w tym jednego weekendowego, z podaniem listy produktów powodujących dolegliwości. Dolegliwościami tymi były tylko wzdęcia, które występowały po spożyciu: pieczywa pszennego, pszenno-żytniego, żytniego na zakwasie, orkiszowego, razowego, kapusty kiszonej, ogórków kiszonych, kalafiora, młodej kapusty, bobu, zielonego groszku, grochu, fasoli, szczawiu, zielonej papryki, cebuli, czosnku, jabłek, gruszek, śliwek, czereśni, moreli, brzoskwini, arbuza, nektarynki, grejpfruta, tłustego mięsa i tłustej wędliny oraz śledzi w occie. Z analizy jadłospisu wynika, że pacjentka przestrzegała ogólnych zaleceń dotyczących realizacji zasad zdrowego żywienia, powinna jednak dokonać korekty w zakresie rodzaju spożywanego tłuszczu (spożywała dużo masła), wprowadzić do menu więcej ryb oraz zrezygnować ze spożywania miodu. Oceny spożycia energii i składników odżywczych dokonano z wykorzystaniem programu komputerowego Dieta 6.0 (tab. 1).
Wykazano niedobór wapnia, którego średnie spożycie z 3 dni stanowiło 63,6% normy zalecanego dziennego spożycia (RDA – recommended dietary allowance), oraz witaminy D (40,9% RDA). Natomiast zbyt duże było spożycie soli z produktów i potraw – 9,4-11,1 g/24 h. Średnie dobowe spożycie cholesterolu pokarmowego z 3 dni wynosiło 395,9 mg. Poza tym znaczny był udział energii z cukrów prostych, co mogło być jednym z czynników mających wpływ na podwyższone stężenie glukozy w surowicy pacjentki (tab. 2). Ostatnie badania laboratoryjne wskazują, że kobieta nadal powinna przestrzegać zaleceń diety lekkostrawnej z ograniczeniem tłuszczu (AlAT 40 j./l) i cukrów prostych (glukoza 107 mg/dl). Stężenie elektrolitów było prawidłowe, poprawiły się wyniki morfologii krwi.
Ponieważ wśród głównych czynników wpływających na florę jelitową znajduje się dieta, jednym z badań dodatkowych wykonanych podczas pierwszego cyklu chemioterapii było pobranie wymazu z odbytu w celu sprawdzenia, czy nie nastąpiła kolonizacja patogenami alarmowymi. Nie wyhodowano enterokoków opornych na wankomycynę (VRE – vancomycin-resistant enterococci), szczepów gronkowca metycylinoopornego (MRSA – methicillin-resistant Staphylococcus aureus), szczepów Enterobacteriaceae wytwarzających karbapenemazy (CPE – carbapenemase-producing enterobacteriaceae) ani szczepów Enterobacteriales wytwarzających β-laktamazy o rozszerzonym spektrum substratowym (ESBL – extended-spectrum beta-lactamases).