Opis przypadku
Ostra hemoliza o śmiertelnym przebiegu – znaczenie przetoczeń krwi
Dr n. med. Mateusz Ziarkiewicz
Lek. Piotr Kacprzyk
Dr n. med. Joanna Drozd-Sokołowska
Nasilenie hemolizy może być zmienne, począwszy od subtelnych odchyleń w badaniach laboratoryjnych, a skończywszy na wstrząsie hemolitycznym prowadzącym do niewydolności wielonarządowej. Ze względu na często dynamiczny charakter procesu i dramatycznie skrócony czas przeżycia krwinek czerwonych ostra hemoliza jest stanem zagrożenia życia, który należy bezwzględnie odróżnić od innych typów niedokrwistości. O szybkości interwencji w ich przypadku decyduje przede wszystkim obecność krwawienia.
Hemoliza to proces rozpadu czerwonych krwinek, który może mieć przyczyny immunizacyjne i nieimmunizacyjne. Towarzyszy jej pobudzenie erytropoezy. Zazwyczaj prowadzi do niedokrwistości. Hemoliza może zachodzić bezpośrednio w świetle naczyń lub też poza nimi – w narządach miąższowych, np. w wątrobie i śledzionie. Z tego względu wyróżnia się hemolizy wewnątrz- i pozanaczyniową, różniące się patomechanizmem. Oddzielnym zjawiskiem jest rozpad komórek prekursorowych erytropoezy w obrębie szpiku kostnego.
Na świecie najczęstszymi przyczynami niedokrwistości hemolitycznych są niedokrwistość sierpowatokrwinkowa oraz malaria. W polskiej populacji dominuje niedokrwistość autoimmunohemolityczna (NAIH) wywołana obecnością autoprzeciwciał reagujących z antygenami czerwonych krwinek.
Kiedy u pacjenta z niedokrwistością można podejrzewać etiologię hemolityczną?
W wywiadzie lekarskim szczególnie istotne jest wcześniejsze rozpoznanie choroby limfoproliferacyjnej, przede wszystkim przewlekłej białaczki limfocytowej (PBL), chorób z autoimmunizacji, zwłaszcza tocznia rumieniowatego, a także przewlekłych chorób wirusowych, m.in. zakażenia HCV, HBV, HIV. Podróże do krajów tropikalnych i gorączka wymagają wykluczenia zarażenia zarodźcami malarii, natomiast pochodzenie etniczne (basen Morza Śródziemnego, Bliski Wschód, Afryka Subsaharyjska, Indie) lub wywiad wrodzonej niedokrwistości są jasną wskazówką sugerującą hemolizę nieimmunizacyjną. Pacjenci z ostrą hemolizą oprócz typowych objawów niedokrwistości mogą zgłaszać:
- stany gorączkowe,
- nocne poty,
- chudnięcie,
- bóle brzucha,
- bóle okolicy lędźwiowej.
Nie występuje odbarwienie stolca, natomiast mocz bywa pomarańczowy do brązowego, a wyjątkowo czerwonobrunatny (nasilona hemoliza wewnątrznaczyniowa, np. w nocnej napadowej hemoglobinurii).
W badaniu przedmiotowym należy poszukiwać:
- tachykardii,
- tachypnoe,
- zażółcenia spojówek, zwykle subtelnego,
- splenomegalii,
- limfadenopatii.
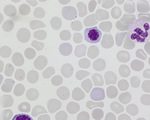
W badaniach dodatkowych na hemolizę wskazuje klasycznie niedokrwistość normocytowa lub makrocytowa z podwyższoną bezwzględną liczbą retikulocytów i obniżonym stężeniem haptoglobiny. Im bardziej nasilona hemoliza, tym większy udział niedojrzałych komórek szeregu erytropoezy o większej objętości. W rozmazie mikroskopowym krwi obwodowej zwraca uwagę obecność erytroblastów na różnych etapach rozwoju, retikulocytów, erytrocytów polichromatofilnych, czasami stwierdza się również obecność schistocytów sugerujących mikroangiopatię. W przypadku niedokrwistości wrodzonych można się spodziewać odpowiednich dla jednostki podstawowej zmian morfologii erytrocytów (ryc. 1).
W wynikach morfologii krwi obwodowej uzyskanych z analizatorów automatycznych stwierdza się wzrost wskaźnika RDW (red cell distribution width), czyli miary anizocytozy krwinek. Mniej swoiste, ale czułe wskaźniki dostępne w większości laboratoriów to aktywność dehydrogenazy mleczanowej (LDH) oraz stężenie bilirubiny pośredniej. Szczególną czujność powinien wzbudzać szybki spadek stężenia hemoglobiny mimo przetoczeń preparatów krwi, a także zła tolerancja niedokrwistości. Niedokrwistości na tle niedoborowym charakteryzuje znacznie lepsza tolerancja. Wysokie zapotrzebowanie na przetoczenia krwi spotyka się także w niewydolności szpiku kostnego (naciek nowotworowy lub dysplazja), jednak od hemolizy stan ten wyraźnie odróżnia liczba retikulocytów. Wyjątkiem od tej reguły jest nabyta aplazja czystoczerwonokrwinkowa (pure red cell aplasia – PRCA), w której hemoliza zachodzi na etapie prekursorów erytropoezy. W konsekwencji niemożliwe jest wytworzenie retikulocytów.
Poniższy opis przypadku ostrej hemolizy obrazuje potencjalne konsekwencje, które może nieść anemia hemolityczna. Ponadto porusza on interesujący problem inicjacji hemolizy przez przetoczenia krwinek czerwonych.
Opis przypadku
69-letnia pacjentka z rozpoznaniem przewlekłej białaczki limfocytowej postawionym w 2005 roku została przyjęta do Kliniki Hematologii, Onkologii i Chorób Wewnętrznych WUM w trybie ostrego dyżuru z powodu znacznego osłabienia, żółtaczki i gorączki utrzymującej się od kilku dni. Chora pozostawała pod opieką oddziału dziennego tutejszej kliniki, gdzie była leczona kilkoma liniami chemioterapii według protokołów: chlorambucyl-prednizon, cyklofosfamid-prednizon, rytuksymab-cyklofosfamid-deksametazon (1 cykl). Co najmniej od 2011 roku stwierdzano dodatni bezpośredni test antyglobulinowy (BTA) z obecnością autoprzeciwciał klasy IgG na krwinkach czerwonych. W związku z progresją choroby podstawowej 30 dni przed przyjęciem do szpitala otrzymała pierwszy cykl chemioterapii według protokołu bendamustyna-prednizon (BP). Pacjentka poza przewlekłym zapaleniem błony śluzowej żołądka oraz nadciśnieniem tętniczym nie zgłaszała innych chorób współistniejących.
Przed podaniem ostatniego cyklu chemioterapii w badaniu morfologii stwierdzano leukocytozę (WBC 53,2 × 103/µl) z dominującą limfocytozą (LYM 51,2 × 103/µl), granulopenię (NEU 0,65 × 103/µl), łagodną niedokrwistość makrocytową (HGB 11,5 g/dl, MCV 109,9 fl) oraz nieistotną klinicznie trombocytopenię (PLT 119 × 103/µl). Trzy dni przed rozpoczęciem hospitalizacji pacjentka była na oddziale dziennym kliniki, wówczas w morfologii stwierdzano umiarkowaną niedokrwistość (HGB 9,0 g/dl). Z uwagi na objawową niedokrwistość zadecydowano wtedy o przetoczeniu dwóch jednostek koncentratu krwinek czerwonych. W następnej dobie wystąpiła gorączka 38,5°C z towarzyszącym silnym bólem w okolicy lędźwiowej. W kolejnej dobie stwierdzano narastanie gorączki do 39-40°C oraz lekko żółtawe zabarwienie skóry. Chora w ciągu tych dni parokrotnie konsultowała się z lekarzami telefonicznie, zalecano leczenie objawowe.
W dniu przyjęcia do kliniki rodzina pacjentki wezwała pogotowie ze względu na silny ból pleców, osłabienie, duszność, żółtaczkę i utrzymywanie się gorączki. Chora została przewieziona do szpitala powiatowego, w którym w godzinach porannych wykonano podstawowe badania krwi obwodowej. W uzyskanych wynikach z istotnych odchyleń stwierdzono: leukocytozę z dominującą limfocytozą, ale z prawidłową liczbą granulocytów (WBC 26,3 × 103/µl, NEU 3,95 × 103/µl, LYM 20,5 × 103/µl), zagrażającą życiu niedokrwistość (HGB 4,8 g/dl, HCT 9,6%, RBC 1,05 × 106/µl, MCV 114,3 fl) oraz łagodną małopłytkowość (PLT 105 × 103/µl). W badaniach biochemicznych z istotnych odchyleń od normy odnotowano stężenie bilirubiny całkowitej 16,7 mg/dl (norma 0,2-1,2 mg/dl), stężenie CRP 223 mg/l (norma 0-10 mg/l), prawidłową aktywność aminotransferaz wątrobowych oraz prawidłowe stężenie troponiny I. Lekarz izby przyjęć po obserwacji pacjentki podjął decyzję o transporcie chorej do kliniki hematologii, trwającym ok. 30 minut.
Artykuł ukazał się

Czasopismo
Onkologia po Dyplomie