Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Onkologia
Ostra białaczka szpikowa – od rozpoznania do leczenia
prof. dr. hab. n. med. Wiesław Wiktor Jędrzejczak
Ostre białaczki szpikowe to nowotwory o gwałtownym przebiegu, które bez leczenia mogą spowodować śmierć w ciągu kilku tygodni. Sposób swoistego leczenia ostrej białaczki szpikowej zależy od jej rodzaju oraz od wieku chorego i schorzeń towarzyszących.
CELE ARTYKUŁU
Po przeczytaniu artykułu Czytelnik powinien umieć:
- rozpoznać objawy wymagające diagnostyki w kierunku ostrej białaczki szpikowej
- zlecić podstawowe badania potwierdzające lub wykluczające ostrą białaczkę szpikową i zinterpretować ich wynik
- rozpocząć podstawowe działania terapeutyczne u chorego z ostrą białaczką szpikową
- przekazać chorego do odpowiedniego ośrodka zajmującego się leczeniem ostrej białaczki szpikowej
- wytłumaczyć choremu strategię postępowania terapeutycznego w ostrej białaczce szpikowej
Wprowadzenie
Ostra białaczka szpikowa, czyli mieloblastyczna, nie jest jedną chorobą, ale grupą (obecnie ponad 20) zbliżonych chorób stanowiących bezpośrednie zagrożenie życia. Ryzyko zachorowania na choroby z tej grupy zwiększa się z wiekiem i można szacować, że rocznie w Polsce zapada na nie 550 osób w wieku <60 r.ż. i około 800 w wieku >60 r.ż. Ten rozdział na grupy wiekowe nie jest teoretyczny, ale wiąże się ze zmianą strategii leczniczej, chociaż granice nie są ostre, gdyż w grę wchodzi jeszcze tzw. wiek biologiczny, schorzenia towarzyszące oraz stan ogólny. Ostre białaczki szpikowe to nowotwory o gwałtownym przebiegu, które bez leczenia mogą spowodować śmierć w ciągu kilku tygodni, chociaż zdarzają się przypadki zarówno o wolniejszym przebiegu, jak i jeszcze szybszym przebiegu.
Kiedy podejrzewać ostrą białaczkę?
Ostra białaczka szpikowa jedynie wyjątkowo jest rozpoznawana podczas przypadkowego badania morfologii krwi wykonywanego u osoby bez objawów chorobowych. Najczęściej chory zgłasza się do lekarza z jednym objawem albo dwoma lub trzema objawami wynikającymi z tzw. triady NZS (niedokrwistość, zakażenie, skaza krwotoczna). Są to więc: bladość, osłabienie, a nawet duszność wysiłkowa, zakażenie bakteryjne, w tym gorączka, krwawienia i krwotoki. Mogą również występować silne bóle kości, a także wysypka lub przerost dziąseł. Jeżeli lekarz skonfrontowany z takimi objawami zleci badanie morfologii krwi, w większości (około 85%) przypadków stwierdzi w niej współistnienie dwóch zjawisk:
- jedno to duża liczby „monocytów” (lub „monocytów” i „limfocytów”), które oczywiście nie są ani jednym, ani drugim rodzajem komórek, tylko blastami białaczkowymi, które aparat liczy w tych okienkach
- drugie to pancytopenia lub bicytopenia prawidłowych komórek, a więc współistnienie niedokrwistości (najczęściej normocytowej), neutropenii i małopłytkowości lub tylko dwóch z tych zaburzeń.
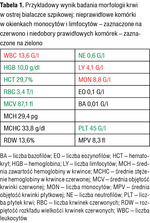
Tabela 1. Przykładowy wynik badania morfologii krwi w ostrej białaczce szpikowej: nieprawidłowe komórki w okienkach monocytów i limfocytów – zaznaczone na czerwono i niedobory prawidłowych komórek – zaznaczone na zielono
U około 15% chorych jedynym zaburzeniem będzie to drugie zjawisko. Są to tzw. białaczki aleukemiczne, w których komórki (blasty) białaczkowe nie są uwalniane do krwi obwodowej.
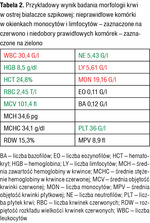
Tabela 2. Przykładowy wynik badania morfologii krwi w ostrej białaczce szpikowej: nieprawidłowe komórki w okienkach monocytów i limfocytów – zaznaczone na czerwono i niedobory prawidłowych komórek – zaznaczone na zielono

Tabela 3. Przykładowy wynik badania morfologii krwi w tzw. aleukemicznej ostrej białaczce szpikowej: niedobory prawidłowych komórek – zaznaczone na zielono
Przykładowe wyniki badań morfologii krwi wykonanych w chwili rozpoznawania ostrej białaczki są podane w tabelach 1-3. Trzeba jednak zaznaczyć, że na podstawie badania morfologii krwi nie można określić, czy ostra białaczka jest mielo, czy limfoblastyczna. Nie stanowi to problemu na tym etapie („przedhematologicznym”), ponieważ zarówno jeden, jak i drugi rodzaj ostrej białaczki jest wskazaniem do możliwie szybkiego skierowania chorego do ośrodka hematologicznego i do hospitalizacji w tym ośrodku, gdzie będzie dokończona diagnostyka.
Istotne jest także, aby możliwie szybko u takiego chorego wykonać koagulogram, gdyż u części chorych występuje zespół wewnątrznaczyniowego wykrzepiania, który może doprowadzić do bardzo masywnej skazy krwotocznej i śmierci chorego przed rozpoczęciem leczenia; chodzi o możliwie szybkie wdrożenie interwencji leczniczej. Paradoksalnie dotyczy to ostrej białaczki promielocytowej, która jest najlepiej poza tym rokującą ostrą białaczką. Tę białaczkę należy podejrzewać zwłaszcza u chorych zgłaszających się z objawami takiej skazy i chorych rasy orientalnej, a więc np. chorych pochodzenia wietnamskiego.
Klasyfikacja ostrych białaczek szpikowych

Tabela 5. Ostre białaczki o niejednoznacznym pochodzeniu (pominięto białaczkę/chłoniaka limfoblastycznego z komórek naturalnej cytotoksyczności [NK – natural killers], gdzie niejednoznaczność dotyczy linii limfoidalnej)
Aktualna klasyfikacja WHO ostrych białaczek szpikowych jest przedstawiona w tabeli 4. Jak z niej wynika, wyróżnia się 22 rodzaje tych białaczek. Tę liczbę trzeba jeszcze uzupełnić o białaczki mieszanokomórkowe, w których transformowane mieloblasty współistnieją z transformowanymi limfoblastami. Podział tych białaczek podany jest w tabeli 5. Co więcej, poszczególne kategorie nie są jednorodne, gdyż na podstawową zmianę decydującą o zakwalifikowaniu do określonej kategorii mogą się nałożyć zmiany dodatkowe mogące mieć istotny wpływ na rokowanie. Możliwość zaklasyfikowania zależy zarówno od możliwości diagnostycznych w danym ośrodku, jak i u danego chorego. Niekiedy chory musi otrzymać leczenie cytostatyczne przed zakończeniem diagnostyki, a po jego zastosowaniu nie ma już wykrywalnych komórek białaczkowych. Inaczej mówiąc, ten sam chory po wykonaniu badań genetycznych może mieć białaczkę sklasyfikowaną jako jedną z białaczek o zdefiniowanej kategorii genetycznej. Jeżeli jednak nie udało się tego zrobić, może być zakwalifikowany do kategorii morfologicznej zbliżonej do kategorii zdefiniowanych w dawnej klasyfikacji FAB (French-American-British Classification). W miarę rozwoju terapii celowanych te podziały mogą zyskać na znaczeniu (leczenie celowane będzie dotyczyło tylko określonego genetycznie rodzaju białaczki), ale obecnie sytuacja decyzyjna jest stosunkowo prosta. Pierwszy zasadniczy podział to oddzielenie ostrej białaczki promielocytowej (PML – promyelocytic leukemia) z t(15:17)(q22:q12); (PML-RARα) od pozostałych. Ostrą białaczkę promielocytową od początku leczy się inaczej. Drugi podział to wydzielenie ostrych białaczek z t(8:21) (q22:q22); (RUNX1:RUNX1T1) lub z inv(16) (p13:1q22), a także t(16:16)(p13.1:q22); (CBFB-MYH11) od pozostałych. W tych białaczkach inne postępowanie dotyczy sytuacji po uzyskaniu remisji całkowitej.
Przyczyny ostrych białaczek szpikowych
Wystąpienie i rozwój ostrej białaczki szpikowej, podobnie jak większości nowotworów, jest wynikiem przypadkowych błędów przy podziale komórki. Tym błędem może być wystąpienie jednej z wyżej wspomnianych translokacji, a także innych mutacji. Jak wiadomo, w trakcie życia w naszych komórkach stale powstają mutacje, przy czym większość z nich jest bez znaczenia. Zależnie od wieku pacjenta w chwili wystąpienia białaczki tych mutacji w komórce, która następnie ulegnie transformacji, może być od 100 do nawet 1000, ale nie zmieniają one istotnie zachowania się komórki i nie dają jej przewagi proliferacyjnej nad innymi komórkami. Dopiero wystąpienie mutacji sprawczej zmienia sytuację i może prowadzić do rozwoju choroby, która jest po prostu potomstwem tej jednej początkowo zmienionej komórki, czyli jest klonem komórkowym. Jednak wystąpienie wspomnianej mutacji sprawczej oprócz dania wyjściowej komórce i jej komórkom potomnym przewagi proliferacyjnej powoduje także niestabilność genomową i tym samym zwiększa podatność tych komórek na następne mutacje. Ich wystąpienie prowadzi do tzw. ewolucji klonalnej białaczki, czyli pojawiania się podklonów o zwiększającej się złośliwości. Nie jest to przy tym zjawisko liniowe i w różnych komórkach potomnych tej samej komórki wyjściowej mogą wystąpić różne mutacje.
Postępowanie objawowe przed zakończeniem diagnostyki
Ostre białaczki szpikowe stwarzają większe bezpośrednie zagrożenie życia niż zabiegi przeszczepienia szpiku. Wynika to stąd, że do zabiegu przeszczepienia chory jest przygotowywany i z reguły wszystkie stany, które mogłyby zagrozić pomyślnemu wykonaniu zabiegu, są wyleczone. Tymczasem zachorowanie na ostrą białaczkę jest jak grom z jasnego nieba. Największym problemem są czynne miejscowe ogniska zakażenia, takie jak zęby z zaawansowaną próchnicą, zapalenie zatok itp. Te sytuacje działają jak bomby z opóźnionym zapłonem. W miarę rozwoju neutropenii z zakażenia okołozębowego może się rozwinąć sepsa, która zabije chorego w ciągu jednego dnia. Nie wszyscy chorzy na ostre białaczki mają neutropenię w chwili rozpoznania, ale u tych, którzy ją mają, powinno być od razu włączone zapobiegawcze leczenie przeciwinfekcyjne w postaci flukonazolu 200 mg dziennie oraz cyprofloksacyny 250 mg 2 razy dziennie lub kotrimoksazolu 480 mg 2 razy dziennie. Chorzy, którzy zgłosili się z objawami zakażenia, powinni być natychmiast intensywnie leczeni z tego powodu.
Podobnie krwotok do ośrodkowego układu nerwowego może zabić chorego, zanim się leczenie rozpocznie, a chory ma szanse na wyleczenie. U starszego chorego może być prowadzone przewlekłe leczenie przeciwkrzepliwe wtedy, kiedy rozwija się u niego ciężka małopłytkowość. Wiele ostrych białaczek, a zwłaszcza ostra białaczka promielocytowa, indukuje zespół wykrzepiania wewnątrznaczyniowego. Wydłużenie czasu protrombinowego, czasu częściowej tromboplastyny po aktywacji (APTT – activated partial thromboplastin time), niskie stężenie fibrynogenu i wysokie stężenie dimeru D u chorego z małopłytkowością powinno skutkować rozpoznaniem zespołu wykrzepiania wewnątrznaczyniowego i wszczęciem postępowania w postaci przetoczenia osocza świeżo mrożonego oraz koncentratu krwinek płytkowych. U chorych krwawiących i chorych z podejrzeniem ostrej białaczki promielocytowej wskazanie do przetoczenia zaczyna się <50 G/l bezwzględnej liczby płytek. U pozostałych chorych na ostre białaczki szpikowe wskazaniem jest liczba <20 G/l.
Odrębnym problemem są chorzy rozpoznawani wyjściowo z dużą liczbą blastów we krwi obwodowej (>100 G/l) i zaburzeniami świadomości. Cierpią oni na zespół nadlepkości i postępowanie przedhematologiczne powinno obejmować nawadnianie i forsowanie diurezy oraz podawanie allopurynolu (ryzyko rozwoju zespołu lizy guza). W ośrodku hematologicznym tacy chorzy powinni mieć możliwie szybko wykonaną leukaferezę leczniczą, aby zmniejszyć ryzyko udaru.
Bezwzględnym wskazaniem do przetoczenia koncentratu krwinek czerwonych jest stężenie hemoglobiny <6 g/dl, ale <9 g/dl są wskazania względne zależne od stanu chorego i schorzeń towarzyszących.
Końcowa diagnostyka ostrych białaczek
Po przyjęciu chorego z podejrzeniem ostrej białaczki do ośrodka hematologicznego należy jednoczasowo przystąpić do określenia dokładnego rodzaju choroby oraz wdrożenia (lub kontynuowania) leczenia objawowego (substytucja składników krwi, leczenie przeciwinfekcyjne itp.). W pierwszej kolejności konieczne jest określenie, czy białaczka jest mielo-, czy limfoblastyczna. Jest to rutynowo określane za pomocą cytometrii przepływowej w oparciu o analizę cząsteczek znajdujących się na powierzchni komórek białaczkowych. Jeżeli chory trafi do ośrodka w godzinach pracy odpowiedniej pracowni i ma blasty we krwi obwodowej, wynik uzyskiwany jest w ciągu kilku godzin. Równolegle wykonywane są rozmazy z krwi obwodowej i w niektórych przypadkach (np. ostra białaczka promielocytowa, ostra białaczka monocytowa) również ich analiza pozwala na wykluczenie ostrej białaczki limfoblastycznej. Jednak w wielu przypadkach mielo- i limfoblasty są podobne i jeśli nie ma dostępu do cytometrii przepływowej, trzeba się posłużyć barwieniami cytochemicznymi.
Kolejnym badaniem jest badanie szpiku, także podstawowe badanie w diagnostyce białaczki aleukemicznej. W tych przypadkach, gdy chory trafia jedynie z pancytopenią bez komórek białaczkowych we krwi obwodowej, różnicowanie dotyczy przede wszystkim niedokrwistości aplastycznej i zespołu mielodysplastycznego, a nie ostrej białaczki limfoblastycznej. Konieczne jest wtedy wykonanie trepanobiopsji (pobranie materiału do analizy histologicznej), a nie tylko biopsji aspiracyjnej. W obydwu sytuacjach konieczne jest jednak pobranie aspiratu szpiku i poddanie go badaniu cytologicznemu (rozmaz), cytometrii przepływowej, cytogenetycznemu i molekularnemu. W oparciu o te badania można dokładnie określić rodzaj ostrej białaczki szpikowej. Jeżeli jednak odsetek blastów w szpiku jest w okolicach 20%, istnieje problem, czy już mamy do czynienia z białaczką, czy jeszcze z zespołem mielodysplastycznym. Jak wiadomo, granicą, powyżej której rozpoznaje się białaczkę, jest 20% blastów (poniżej tej liczby właściwe rozpoznanie to zespół mielodysplastyczny z nadmiarem blastów II). W takich przypadkach należy ten odsetek obliczać, analizując większą liczbę komórek, tj. 500 lub nawet 1000, aby zmniejszyć ryzyko niewłaściwej kwalifikacji rzutujące następnie na wybór postępowania leczniczego.
Leczenie ostrych białaczek szpikowych
Po przyjęciu do ośrodka hematologicznego trzeba w pierwszej kolejności opanować bezpośrednie zagrożenie życia i przygotować chorego do intensywnej terapii. Z jednej strony jest to kontynuowanie czynności wspomnianych wcześniej, a z drugiej – założenie centralnego cewnika żylnego, sanacja jamy ustnej (niekiedy trzeba usunąć nawet kilkanaście zębów).
Sposób swoistego leczenia ostrej białaczki szpikowej zależy od jej rodzaju oraz od wieku chorego i schorzeń towarzyszących. Pierwszym celem jest uzyskanie remisji całkowitej, czyli nieobecności blastów białaczkowych w standardowym badaniu (a więc <5% blastów szpiku) oraz odnowy prawidłowego krwiotworzenia. O ile w chwili rozpoznania chory na białaczkę ma około biliona komórek białaczkowych, uzyskanie remisji całkowitej oznacza zmniejszenie tej liczby do <1 miliarda. Droga do wyleczenia prowadzi przez konsolidację remisji, której zadaniem jest dalsze zmniejszenie tej liczby do <1 miliona. I wreszcie celem przeszczepienia jest całkowite wyeliminowanie choroby. Alternatywnie próbuje się utrzymać liczbę tych komórek na poziomie niewykrywalnym lub u chorych z oporną białaczką albo niezdolnych do przeżycia agresywnego leczenia – na jak najniższym poziomie możliwie długo.
W ostrej białaczce promielocytowej zalecane leczenie indukcyjne to skojarzenie tretynoiny (kwasu all-trans retinowego) z idarubicyną. To leczenie może zostać wkrótce zastąpione również w Polsce przez skojarzenie tretynoiny z trójtlenkiem arsenu. Będzie to pierwsza sytuacja w jakiejkolwiek ostrej białaczce, w której standard będzie obejmował leczenie indukcyjne niewykorzystujące cytostatyków. Takie leczenie będzie możliwe do zastosowania u chorych w każdym wieku. Powoduje ono bardzo wysoki odsetek trwałych całkowitych remisji. Tretynoinę należy zacząć podawać możliwie szybko. Indukuje on dojrzewanie promielocytów do neutrofili i może spowodować tzw. zespół kwasu retinowego, zwłaszcza u chorych z wyjściowo dużą liczbą komórek białaczkowych. Objawia się on gorączką, dusznością, niedotlenieniem i zatrzymaniem płynów. Należy zastosować deksametazon 10 mg dożylnie 2 razy dziennie i leczenie objawowe. W ciężkich przypadkach należy czasowo przerwać podawanie tretynoiny.
U chorych w wieku <60 r.ż. z pozostałymi rodzajami ostrej białaczki szpikowej wykorzystuje się strategię, którą skrótowo można określić jako IKP (skrót pochodzi od: indukcja remisji, konsolidacja remisji i przeszczepienie szpiku). To oznacza, że na etapie badania wstępnego u takiego chorego trzeba wyjaśnić sprawę istnienia rodzeństwa (jako potencjalnych dawców komórek krwiotwórczych) oraz pobrać materiał na badanie antygenów zgodności tkankowej (HLA – human leukocyte antygen) w celu umożliwienia poszukiwania dawcy w okresie, kiedy chory będzie poddawany leczeniu przedprzeszczepieniowemu. Standardowym leczeniem mającym na celu indukcję remisji jest skojarzenie daunorubicyny podawanej przez 3 dni z cytarabiną (arabinozydem cytozyny) podawanym przez 7 dni we wlewie ciągłym (tzw. 3 + 7). Protokół ten w Polsce i niektórych innych krajach jest wzbogacony o dodatek kladrybiny (tzw. protokół DAC). Zastosowanie tego protokołu powoduje całkowitą remisję u około 50% chorych po jego pierwszym podaniu i u połowy spośród pozostałych po drugim (reindukcji) podaniu, czyli razem u 70-75% chorych. Remisję tę następnie konsoliduje się cytarabiną podawaną w dużych dawkach. U chorych z białaczkami spowodowanymi wyłącznie przez translokację 8:21 lub inwersję chromosomu 16 może to być leczenie wystarczające do uzyskania długoletniego przeżycia wolnego od choroby. W pozostałych przypadkach leczeniem zmierzającym do wyleczenia jest przeszczepienie szpiku od innej osoby (allogenicznego) po kondycjonowaniu mieloablacyjnym (u chorych >50-55 r.ż. o zredukowanej intensywności). Ostatecznie prowadzi to do wyleczenia około 50% z tej grupy chorych.
U pozostałych chorych albo choroba nawraca mimo przeszczepienia, albo giną oni z powodu powikłań zabiegu. Chorzy, u których nie uzyskano remisji całkowitej po dwóch cyklach, mają znikome szanse uzyskać ją po trzecim cyklu indukcyjnym, więc są kandydatami do leczenia paliatywnego lub są poddawani tzw. ratunkowemu przeszczepieniu allogenicznego szpiku. Z tej grupy rekrutuje się też kandydatów do różnych badań klinicznych, gdyż ze względu na krańcowo złe rokowanie mogą oni najbardziej skorzystać w razie powodzenia terapii innowacyjnej.
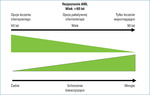
Rycina 1. Zależność rodzaju postępowania leczniczego u chorych powyżej 60 r.ż. od wieku i obecności schorzeń towarzyszących
Standardowym leczeniem paliatywnym jest stosowanie hydroksymocznika (zaczynając od dawki 2 lub 3 razy dziennie po 500 mg i następnie dostosowując dawkę dzienną do sytuacji). Jest to leczenie doustne, które chory może kontynuować w domu i lepiej wykorzystać dla swoich celów pozostały mu czas życia niż w warunkach szpitalnych. Chociaż leczenie to nie prowadzi do wyleczenia ani do uzyskania remisji całkowitej, niekiedy pozwala przeżyć nawet 2 lata. Zwykle chory ma w tym czasie umiarkowaną pancytopenię i wymaga okresowego podawania składników krwi. W razie złej tolerancji albo dużej toksyczności hydroksymocznika można go próbować zastąpić również stosowanymi doustnie merkaptopuryną (2 razy dziennie po 50 mg i następnie dostosowywać do sytuacji) lub melfalanem. U części chorych można też próbować stosować cytarabinę w małych dawkach. Wreszcie, nowym rozwiązaniem jest stosowanie azacytydyny, zwłaszcza jako leczenia pomostowego do transplantacji. Takie leczenie wykorzystujące inny mechanizm działania (demetylację antyonkogenów) może nawet prowadzić do uzyskania remisji całkowitej u niektórych chorych.
U chorych >60 r.ż. sytuacja jest różnorodna. Przede wszystkim istnieje zróżnicowanie wiekowe i trzeba nieco inaczej traktować chorych w kolejnych dekadach (ryc. 1). Im bliżej 60 r.ż., tym leczenie może być bardziej zbliżone lub nawet identyczne jak u chorych poniżej tego wieku, a im dalej od tej granicy, tym intensywność leczenia musi być zmniejszana, a większa waga przywiązywana do leczenia paliatywnego lub tylko objawowego. Na wiek biologiczny nakładają się schorzenia dodatkowe, które w różny sposób (zależnie od tego, którego narządu dotyczą) mogą ograniczać możliwości leczenia. Istnieją algorytmy kompleksowej oceny stanu chorego, które ułatwiają podejmowanie decyzji leczniczych. W dodatku wymieniona bariera wieku przestała też być przeciwwskazaniem do leczenia przeszczepieniem allogenicznym, z tym że wykonuje się je po zredukowanym kondycjonowaniu. Najprościej jednak kierować się skalą Zubroda do oceny stanu ogólnego. Chorzy w stanie 0-1 (chorzy bez objawów i normalnie aktywni) mogą być rozpatrywani pod kątem leczenia intensywnego, chorzy w stanie 2 (>50% dnia poza łóżkiem) do leczenia paliatywnego i chorzy w stanie 3-4 (>50% dnia w łóżku) do leczenia objawowego, chociaż u młodszych (spośród starszych) chorych w stanie 3 można jeszcze próbować wdrażać leczenie paliatywne.
U chorych, którzy nie kwalifikują się do przeszczepienia, leczeniem z wyboru staje się azacytydyna (podskórnie 75 mg/m2 przez 7 dni, cykle 28-dniowe), co jednak nie jest najwygodniejsze dla chorego, gdyż wymaga dla uzyskania i podtrzymania remisji comiesięcznych cykli podawanych w szpitalu tak długo, jak długo utrzymuje się działanie. W badaniach klinicznych znajduje się doustny preparat tego związku, ale potrzeba kilku lat, zanim stanie się on dostępny handlowo. Niektórzy chorzy, którzy uzyskali remisję całkowitą dzięki azacytydynie, mogą być kwalifikowani do przeszczepienia. Wreszcie azacytydyna może być stosowana u chorych z nawrotem białaczki po przeszczepieniu.
Jednocześnie trwają badania kolejnych nowych leków z grupy tzw. leków celowanych. Najczęściej testowane są inhibitory kinazy tyrozynowej FLT3. Z leków tej grupy dostępny w Polsce jest sorafenib, który jednak jest refundowany jedynie w swoich pierwotnych wskazaniach. Jednak zróżnicowanie genetyczne ostrych białaczek szpikowych jest tak duże, że jest mało prawdopodobne, aby sukces tretynoiny i trójtlenku arsenu w ostrej białaczce promielocytowej został powtórzony w innych rodzajach tych chorób w bliskiej przyszłości.
Leczenie objawowe sprowadza się do uzupełniania niedoborów składników krwi (głównie przetoczenia koncentratów krwinek czerwonych i płytkowych) oraz do profilaktyki i zwalczania zakażenia.
Podsumowanie
Ostre białaczki szpikowe pozostają wyzwaniem dla współczesnej medycyny, mimo ogromnych osiągnięć w poznawaniu ich biologii i wdrażaniu nowych metod leczenia. W miarę starzenia się społeczeństwa stają się chorobami coraz bardziej częstymi i agresywne metody ich leczenia wcześniej opracowane dla młodych chorych są trudne do stosowania ze względu na zły stan ogólny i obecność schorzeń towarzyszących u wielu chorych. Ich różnorodność sprawia, że opracowanie mało toksycznych celowanych metod o szerokim zastosowaniu wydaje się nieprawdopodobne. Niemniej trwają badania kliniczne nad kilkoma lekami, które wstępnie dają korzystne wyniki, a kolejne cząsteczki są w fazie badań przedklinicznych.



