Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Temat numeru
Stłuszczenie wątroby – diagnostyka i leczenie
dr n. med Jan Gietka1,3
lek. Jakub Klapaczyński2,3
Niealkoholowa stłuszczeniowa choroba wątroby, uważana za wątrobową manifestację zespołu metabolicznego, jest najczęstszą chorobą wątroby w krajach rozwiniętych. Rosnąca częstość jej występowania koreluje z pandemią otyłości i cukrzycy typu 2.
CELE ARTYKUŁU
Po przeczytaniu artykułu Czytelnik powinien umieć:
- zinterpretować wynik stłuszczenia wątroby w badaniu USG
- rozpoznać przypadki stłuszczenia wątroby wymagające dalszej diagnostyki i leczenia
- wdrożyć podstawową diagnostykę stłuszczenia wątroby
- omówić strategię postępowania terapeutycznego w przypadku stłuszczenia wątroby
Wprowadzenie
Niealkoholowa stłuszczeniowa choroba wątroby (NAFLD – non-alcoholic fatty liver disease) występuje u 20-40% populacji ogólnej, 50% osób z cukrzycą typu 2 oraz 70% z otyłością.1
Obejmuje wiele postaci klinicznych – od zwykle łagodnego stłuszczenia prostego poprzez stłuszczeniowe zapalenie wątroby, aż do zaawansowanego włóknienia i marskości. Ponadto NAFLD jest czynnikiem ryzyka rozwoju chorób układu sercowo-naczyniowego. Stanowią one główną przyczynę zgonów u chorych na to schorzenie.
Jak dotąd, mimo wielu badań, nie ma skutecznych leków swoiście zmniejszających aktywność stłuszczeniowego zapalenia wątroby. Ponieważ kluczowa w patogenezie tej choroby jest otyłość, wysiłki terapeutyczne skierowane są w pierwszej kolejności na redukcję masy ciała.
Czy można lekceważyć NAFLD?
Pomimo przewlekłego przebiegu i rozpowszechnienia stłuszczeniowa choroba wątroby nie powinna być lekceważona. Śmiertelność chorych z NAFLD w czasie 15 lat od rozpoznania jest o 35-70% wyższa niż osób bez NAFLD. Najczęściej wiąże się z chorobami układu sercowo-naczyniowego. Współistnienie zespołu metabolicznego wpływa na gorsze rokowanie w porównaniu z populacją ogólną. U pacjentów z NAFLD choroby wątroby są trzecią najczęstszą przyczyną zgonu (po chorobach nowotworowych); u tych bez NAFLD dopiero na 13 miejscu.2
Ryzyko zgonu zależy nie tyle od nasilenia zapalenia wątroby, ile od zaawansowania włóknienia. Najistotniejsze w ocenie klinicznej jest zatem wykrycie chorych z zaawansowanym włóknieniem lub marskością wątroby oraz zagrożonych szybką progresją włóknienia.
Wyróżniamy dwie podstawowe manifestacje choroby o zasadniczo odmiennym rokowaniu. Rozróżnienia możemy dokonać jedynie na podstawie oceny histologicznej bioptatu wątroby:
1. Stłuszczenie proste (NAFL – non-alcoholic fatty liver) – najczęściej łagodne, stanowiące ok. 80% przypadków NAFLD, definiowane histologicznie jako obecność stłuszczenia >5% hepatocytów z możliwością towarzyszących nacieków zapalnych lub zwyrodnienia balonowatego hepatocytów.
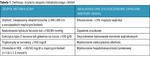
2. Niealkoholowe stłuszczeniowe zapalenie wątroby (NASH – non-alcoholic steatohepatitis) – związane z progresją do marskości oraz wysokim ryzykiem powikłań sercowo-naczyniowych, stanowiące ok. 20% NAFLD; do rozpoznania oprócz obecności stłuszczenia konieczne jest stwierdzenie zapalenia i zwyrodnienia balonowatego hepatocytów (tab. 1).
Tradycyjnie uważano, że stłuszczenie proste nie prowadzi do progresji choroby i postępu włóknienia, a przy zachowaniu niezmiennej sytuacji metabolicznej chorego nie przechodzi w NASH. Ostatnie badania oparte na seryjnie wykonywanych biopsjach sugerują jednak, że patologie te należy traktować jako kolejne stadia choroby. Progresję włóknienia obserwowano zarówno u pacjentów z NAFL, jak i NASH. Różnił je czas – średnio 14 lat w NAFL oraz 7 lat w NASH na 1 stopień włóknienia. W przypadku współistnienia nadciśnienia tętniczego czas progresji włóknienia skracał się 2-krotnie. Badania obserwacyjne wskazują powtarzalnie, że ryzyko rozwoju marskości wątroby w ciągu 15 lat obserwacji wynosi niecałe 11% u chorych z NASH oraz 0,7% u chorych z NAFL; ryzyko śmierci odpowiednio – 7,3% i 0,9%.3 Identyfikacja postaci NAFLD ma istotny wpływ na leczenie. Ze względu na znacznie gorsze rokowanie swoista farmakoterapia powinna być stosowana przede wszystkim przy potwierdzonym NASH.
Czego się spodziewać w badaniu ultrasonograficznym?
Stłuszczenie wątroby nie daje charakterystycznych objawów klinicznych. Chorobę wykrywa się zwykle podczas badania ultrasonograficznego jamy brzusznej wykonanego często z innych wskazań. Klasyczny obraz ultrasonograficzny to zwiększona echogeniczność miąższu wątroby, której może towarzyszyć umiarkowane powiększenie narządu. Typowym znaleziskiem jest wyróżniający się obszar oszczędzonej wątroby (czyli mniejszego stłuszczenia) w okolicy pęcherzyka żółciowego (w segmencie IVb), interpretowany czasami błędnie jako lita zmiana ogniskowa.
Ultrasonografia to najpowszechniejsze badanie obrazowe do wykrywania stłuszczenia wątroby z powodu dostępności, ceny i bezpieczeństwa. Dokładniejsze techniki (rezonans magnetyczny czy tomografia komputerowa) wykorzystywane są do badań klinicznych i nie powinny być rutynowo stosowane. Badanie ultrasonograficzne umożliwia wykrycie zdecydowanej większości przypadków stłuszczenia o średnim i dużym nasileniu. Gdy zajmuje ono <30% hepatocytów, czułość ultrasonografii spada.4 Kolejnymi istotnymi ograniczeniami są subiektywność oceny oraz gorsza wizualizacja wątroby u osób otyłych.
Postępowanie diagnostyczne u pacjenta ze stłuszczeniem wątroby
Każdy chory ze stwierdzonym ultrasonograficznie stłuszczeniem wątroby wymaga wstępnej diagnostyki ze szczególnym naciskiem na identyfikację objawów zespołu metabolicznego (tab. 1) oraz wykluczenia zaawansowanego włóknienia i marskości wątroby (tab. 2 i 3).
Ponieważ rozpoznanie NAFLD jest diagnozą z wykluczenia, w przypadku utrzymującej się przewlekle (czyli >6 miesięcy) zwiększonej aktywności aminotransferaz konieczne jest skierowanie chorego do poradni specjalistycznej na badania w kierunku innych chorób wątroby:
- zakażeń wirusami hepatotropowymi (HBsAg, przeciwciała anty-HCV – jeśli nie wykonano ich wcześniej)
- chorób autoimmunologicznych: immunoglobuliny IgG, autoprzeciwciała wątrobowe (ANA, SMA, LKM1, SLA/LP, a także AMA w przypadku zwiększonej aktywności fosfatazy alkalicznej)
- zaburzeń gospodarki żelazowej (łącznie z ferrytyną proponujemy oznaczanie wysycenia transferyny, gdyż u chorych z NAFLD często stwierdza się hiperferrytynemię)
- wykluczenie niedoboru α1-antytrypsyny, choroby Wilsona, choroby trzewnej
- pogłębienie wywiadu na temat zażywanych leków, ziół, odżywek, chorób wątroby w rodzinie.
Ze względu na częstość występowania stłuszczenia wątroby nierzadko obserwujemy nakładanie się innych chorób wątroby na NAFLD (najczęściej choroby alkoholowej i przewlekłego WZW typu C).
Czy konieczna jest biopsja wątroby?
Głównymi czynnikami determinującymi rokowanie chorych z NAFLD są zaawansowanie włóknienia oraz ocena ryzyka jego progresji. W praktyce sprowadza się to do identyfikacji chorych z NASH.
Złotym standardem oceny włóknienia oraz jedyną metodą pozwalającą w sposób pewny odróżnić zapalenie stłuszczeniowe od stłuszczenia prostego jest biopsja wątroby. Szczególną grupą, w której trzeba rozważyć to badanie, są osoby z czynnikami ryzyka NASH i szybkiej progresji włóknienia. Należy u nich wdrożyć program terapeutyczny polegający nie tylko na zmianie stylu życia, ale również farmakoterapii. Do tej grupy zaliczyć należy przede wszystkim chorych z: nadciśnieniem tętniczym, cukrzycą typu 2 oraz chorych z wysoką aktywnością aminotransferaz.
Biopsja wątroby to jednak zabieg inwazyjny i kosztowny. Wynik jest obarczony możliwością błędu próbki (ocenie poddajemy ok. 1/50 tys. objętości wątroby).
Nieinwazyjne metody oceny włóknienia wątroby
Z powodu ograniczeń biopsji wątroby rosnącą popularność w ocenie włóknienia zyskują metody nieinwazyjne. Wykorzystywane są do oceny przesiewowej w celu wykluczenia zaawansowanego włóknienia wątroby oraz monitorowania przebiegu choroby.
Możemy tu wyróżnić niekomercyjne testy opierające się na analizie danych klinicznych (jak masa ciała, wiek, BMI) i prostych wyników badań laboratoryjnych (AST, ALT, PLT, albuminy), np. NFS – nalfd fibrosis score (http://nafldscore.com/), FIB-4 (fibrosis 4 calculator) czy BARD oraz komercyjne.5
Najczęściej wykorzystywaną metodą nieinwazyjnej oceny włóknienia jest elastografia. Obecnie dostępnych jest wiele konkurencyjnych metod, będących niejednokrotnie dodatkową funkcją powszechnie używanych aparatów do USG. Badania elastograficzne są bardziej wiarygodne w ocenie marskości (F4) niż zaawansowanego włóknienia (F3). Częściej dają wyniki fałszywie dodatnie niż fałszywie ujemne. Oznacza to, że elastografię należy traktować przede wszystkim jako badanie wykluczające zaawansowane włóknienie i marskość. U 20% pacjentów wyniki nie spełniają kryteriów wiarygodności, szczególnie u osób otyłych. Pozostałe ograniczenia badania przedstawiono w tabeli 4.
Jednoczesna ocena z użyciem pośrednich testów oceny włóknienia i elastografii może dostarczyć pewniejszych informacji o stopniu włóknienia, przy założeniu uzyskania zbieżnych wyników. W przypadkach wątpliwych powinna rozstrzygać biopsja wątroby (tab. 5).
Marskość kryptogenna
NAFLD jest uważane za główną przyczynę tzw. marskości kryptogennej, czyli marskości o nieznanej etiologii. Co ciekawe, w zaawansowanej marskości wątroby przeważają zjawiska kataboliczne i przez to klasycznie współistniejące z NAFLD zaburzenia metaboliczne mogą być nieobecne.
Często zdarza się, że tacy chorzy nie są już otyli, mają niższe ciśnienie tętnicze, nie mają zaburzeń lipidowych (w marskości stężenie cholesterolu dramatycznie spada), może się u nich wycofywać cukrzyca. Histologicznie natomiast dominuje zaawansowane włóknienie, z wycofaniem się typowych dla NASH stłuszczenia, zapalenia i zwyrodnienia balonowatego (tzw. burned-out NASH). Dlatego kluczowy jest dokładny wywiad. Pacjentów trzeba zapytać o maksymalną dotychczasową masę ciała, jej zmiany oraz choroby przewlekłe, na które chory się leczył.
Jak leczyć?
Towarzystwa naukowe zalecają w wytycznych swoiste leczenie przede wszystkim u chorych z histologicznie potwierdzonym niealkoholowym stuszczeniowym zapaleniem wątroby. Gdy nie można wykonać biopsji, powinno się dokładnie monitorować wszystkich pacjentów z podwyższoną aktywnością aminotransferaz, mogącą oznaczać większą aktywność martwiczo-zapalną prowadzącą do rozwoju włóknienia (tab. 6).
Leczenie niefarmakologiczne
Redukcja masy ciała
Otyłość odgrywa kluczową rolę w patofizjologii rozwoju NAFLD, dlatego redukcja masy ciała jest podstawą skutecznego postępowania i leczeniem pierwszego rzutu. Niejednokrotnie efekt zmiany masy ciała jest łatwo zauważalny podczas dokładnie przeprowadzanego wywiadu. Poprawę aktywności aminotransferaz w badaniach kontrolnych można zaobserwować nawet po kilkukilogramowej utracie masy ciała, wynikającej z lęku chorego po stwierdzeniu zapalenia wątroby. Redukcja masy ciała powinna wynosić nie mniej niż 7%. Można wówczas liczyć na wycofanie składowych NASH (stłuszczenia, zapalenia oraz zwyrodnienia balonowatego).6 Utrata ≥10% pierwotnej masy ciała bywa konieczna do zmniejszenia włóknienia wątroby. U 97% pacjentów, którzy stracili >10% m.c., uzyskuje się remisję NAFLD.7
Podczas konsultacji należy dokładnie wyznaczyć planowaną masę ciała i silnie zmotywować chorego do jej osiągnięcia, ponieważ wysiłek prowadzący do schudnięcia często jest krótkotrwały. Warto wprowadzić stałe, proste zasady dietetyczne, które mógłby on kontynuować przez długi czas (np. ograniczenie pieczywa, eliminacja słodzonych napojów).
Dieta
Dieta w NAFLD powinna mieć na celu poprawę NAFLD oraz redukcję ryzyka rozwoju chorób współistniejących z NAFLD, takich jak choroby układu sercowo-naczyniowego czy cukrzyca. Dotychczasowe badania wskazują raczej na korzystny względem NAFLD efekt ogólnej restrykcji kalorycznej niż na szczególną skuteczność konkretnych zaleceń dietetycznych. Osoby z ryzykiem metabolicznym powinny przestrzegać diety niskokalorycznej z redukcją energii o 30%.
Korzystne u pacjentów z zespołem metabolicznym jest wdrożenie diety śródziemnomorskiej lub zwiększenie spożycia n-3 wielonienasyconych kwasów omega (PUFAs).8 Należy ograniczyć spożycie sztucznej fruktozy (niepochodzącej z owoców). W społeczeństwach rozwiniętych jej źródłem są przede wszystkim słodzone napoje oraz cukier. Liczne badania wykazały związek NAFLD i progresji włóknienia z wysoką zawartością syropu fruktozowego w diecie.9
Niepotrzebna jest dieta lekkostrawna czy tzw. wątrobowa. Pokarmy smażone, ciężkostrawne mogą być przyczyną dolegliwości bólowych pochodzenia jelitowego, ale u chorych z niealkoholową stłuszczeniową chorobą wątroby większy nacisk należy położyć na cel, jakim jest obniżenie masy ciała, niż na to, czym odżywia się chory.
Aktywność fizyczna
Regularna aktywność fizyczna zmniejsza prawdopodobieństwo rozwoju cukrzycy typu 2, nadciśnienia tętniczego, dyslipidemii, zespołu metabolicznego i insulinooporności, a więc zarówno chorób towarzyszących NAFLD, jak i przyczyn tego zaburzenia. Metaanalizy wykazały zmniejszenie zawartości tłuszczu w wątrobie pod wpływem ćwiczeń fizycznych.10
Korzystne efekty związane z aktywnością fizyczną wykazują efekt zależny od dawki. Korzystniejszy jest wysiłek dłuższy i intensywniejszy (bieganie) niż o umiarkowanym nasileniu (spacery).
Należy nie tylko zwiększać aktywność fizyczną, ale również unikać spoczynkowego trybu życia. Wykazano, że długotrwałe siedzenie wykazuje dodatnią korelację z występowaniem NAFLD, niezależną od stopnia aktywności fizycznej.11
Kawa
Należy zachęcać pacjentów do spożywania przynamniej 2 filiżanek kawy dziennie. Istnieje coraz więcej dowodów na to, że spożywanie kawy poprawia histologiczny obraz wątroby u chorych z NAFLD oraz spowalnia przebieg włóknienia w różnych chorobach wątroby, w tym w NASH.10,12
Eliminacja innych czynników hepatotoksycznych
Należy ograniczyć wpływ innych potencjalnych czynników hepatotoksycznych, z których najważniejszy to alkohol. Bezpieczne dobowe ilości alkoholu, które nie powodują stłuszczenia wątroby, to nie więcej niż 30 g u mężczyzn i 20 g u kobiet.
U chorych z marskością wątroby w przebiegu NASH zaleca się całkowitą abstynencję. Zmniejsza to ryzyko rozwoju raka wątrobowokomórkowego (HCC – hepatocellular carcinoma).
Należy również rozważyć przerwanie terapii lekami mogącymi nasilać stłuszczenie wątroby (przede wszystkim glikokortykosteroidy, metotreksat, kwas walproinowy, estrogeny, tamoksyfen).
Leczenie internistyczne
Chorzy z NAFLD powinni być objęci szczególną opieką internistyczną. Częściej współistnieją u nich choroby układu sercowo-naczyniowego, cukrzyca typu 2, dyslipidemia, przewlekła choroba nerek, choroby endokrynologiczne (niedoczynność tarczycy) oraz nowotworowe.
Szczególnie istotne są dobra kontrola cukrzycy typu 2 oraz skuteczne leczenie nadciśnienia tętniczego, gdyż obie te choroby przyspieszają włóknienie wątroby.
W leczeniu nadciśnienia tętniczego u chorych z NAFLD zasadny jest wybór leków z grupy antagonistów receptora dla angiotensyny II. Blokując układ renina-angiotensyna-aldosteron, leki te mogą przeciwdziałać rozwojowi insulinooporności. W przypadku stosowania telmisartanu, który wykazuje unikalne działanie jako modulator PPAR-γ, stwierdzono znaczne zmniejszenie nasilenia składowych NASH oraz regresję włóknienia wątroby.13,14
Swoista farmakoterapia NAFLD
Swoiste leczenie farmakologiczne powinno być stosowane przede wszystkim u chorych:
- z potwierdzonym biopsyjnie NASH
- u których zmiany stylu życia nie powodują poprawy stanu zdrowia
- niemogących trwale zredukować masy ciała
- z czynnikami ryzyka szybkiego postępu włóknienia (cukrzyca typu 2, nadciśnienie tętnicze, wysoka aktywność aminotransferaz).)
Antyoksydanty
Lekiem pierwszego rzutu u chorych z NAFLD bez cukrzycy jest witamina E (tokoferol), skuteczna w dawce dobowej 800 j.m. Wykazano, że u chorych bez cukrzycy poprawia ona histologiczne i biochemiczne objawy NAFLD, ale nie wpływa na włóknienie wątroby.15 Dłuższe stosowanie witaminy E wiąże się jednak z ryzykiem rozwoju chorób nowotworowych (szczególnie raka prostaty) oraz chorób układu sercowo-naczyniowego. Dlatego terapia taka przeznaczona jest dla chorych z potwierdzonym biopsyjnie NASH bez cukrzycy. Nie powinna jednak trwać dłużej niż 12 miesięcy.
Leki zwiększające wrażliwość na insulinę
Pioglitazon, lek przeciwcukrzycowy z grupy tiazolidynedionów, poprawia wszystkie składowe histologiczne NASH oraz obniża aktywność enzymów wątrobowych. Dotychczasowe badania wykazały niejednoznaczny wpływ na włóknienie.16,17 Przyrost masy ciała, do którego dochodzi u 75% osób przyjmujących pioglitazon, w długiej perspektywie może redukować korzystne bezpośrednie efekty terapii. Do tej pory nie określono optymalnego czasu trwania leczenia. Ponadto leku tego należy unikać u osób z przewlekłą niewydolnością serca, rakiem pęcherza moczowego oraz przy zwiększonym ryzyku osteoporozy.
Zgodnie z obowiązującymi wytycznymi zaleca się pioglitazon w dawce 30 mg/24 h u chorych z potwierdzonym histopatologicznie NASH i współistniejącą cukrzycą typu 2. Strategia ta może być jednak zbyt restrykcyjna, zwłaszcza że wszystkie dotychczasowe badania naukowe, w których wykazano korzystny efekt jego działania, przeprowadzono u pacjentów bez cukrzycy.
Zgodnie z zaleceniami towarzystw diabetologicznych lekiem pierwszego rzutu w cukrzycy typu 2/stanie przedcukrzycowym jest metformina. Badania nad jej bezpośrednim wpływem na zmiany histologiczne w przebiegu NASH są jednak niejednoznaczne. Dowiedziono natomiast jej korzystny, pośredni efekt poprzez redukcję masy ciała.17
Statyny
Wbrew często powtarzanej obiegowej opinii stosowanie statyn nie jest przeciwwskazane u chorych z podwyższoną aktywnością aminotransferaz. Obserwowane u niektórych zwiększenie aktywności aminotransferaz określane jest głównie jako przemijający fenomen biochemiczny. Leki te nie mają wyraźnie dowiedzionego korzystnego działania swoistego u pacjentów z niealkoholową stłuszczeniową chorobą wątroby. 70% chorych z NAFLD ma jednak dyslipidemię i u nich statyny powinno się stosować jak u chorych bez NAFLD. Poprzez zmniejszenie stężenia cholesterolu i przeładowania tłuszczowego mogą one poprawiać wyniki biochemiczne.
Wielonienasycone kwasy tłuszczowe omega-3
Wyniki badań naukowych są niejednoznaczne, ale metaanalizy wskazują, że zwiększona podaż wielonienasyconych kwasów tłuszczowych omega-3 (PUFAs) zwiększa wrażliwość na insulinę i zmniejsza stopień stłuszczenia wątroby.18 Nie określono dotąd skutecznej dawki, korzyści widoczne są jednak od dawki ≥0,83 g kwasów omega-3/24 h.
Leki hepatoprotekcyjne
Uważano, że kwas ursodeoksycholowy wpływa na zmniejszenie kaskady stanu zapalnego oraz zjawiska apoptozy komórkowej. Badania naukowe nie potwierdziły jednak istotnego wpływu na histologiczne parametry NASH, ale jedynie nieznaczną poprawę biochemiczną.19 Obecnie leku nie stosuje się w terapii NAFLD (tab. 7).
Chirurgia bariatryczna
Pomimo leczenia niewielki odsetek chorych z NAFLD osiąga trwałą utratę masy ciała. Z pomocą może przyjść chirurgia bariatryczna zapewniająca długotrwałą i znaczną redukcję. To bardzo skuteczna metoda. Powoduje nie tylko ustąpienie NAFLD, ale również zmniejsza nasilenie składowych definiujących zespół metaboliczny. U pacjentów ze spektakularnym obniżeniem masy ciała po operacji otyłości wykazano nie tylko wybitną poprawę histologiczną, ale nawet częściowe cofnięcie się zmian marskich.20 Jak dotąd nie ustalono przewagi którejkolwiek z bariatrycznych metod chirurgicznych.21 W Polsce leczenie bariatryczne refundowane jest u chorych z BMI >40.
Transplantacja wątroby
U chorych z niewydolnością wątroby i rakiem wątroby należy rozważyć wskazania do przeszczepienia wątroby. W Europie Zachodniej i USA NAFLD jest obecnie trzecią najczęstszą przyczyną transplantacji wątroby z wyraźną tendencją rosnącą (w Polsce rzadziej).22 Ze względu na liczne choroby towarzyszące (nadciśnienie tętnicze, otyłość, cukrzyca) śmiertelność wczesna po przeszczepieniu u chorych z NAFLD jest niestety wyższa niż po przeszczepieniach wątroby z innych wskazań. Wynika przede wszystkim z powikłań sercowo-naczyniowych lub sepsy. Długofalowe przeżycia nie różnią się jednak wyraźnie od chorych bez NAFLD. Ryzyko nawrotu marskości w przebiegu NASH w przeszczepionym narządzie jest bardzo małe (~2%).