Od reumatologa dla dermatologów
Twardzina układowa – współczesne możliwości terapeutyczne
Dr n. med. Bogna Grygiel-Górniak, dr hab. med. Mariusz Puszczewicz
Badania dotyczące metod leczenia zarówno postaci morfea, jak i układowej, są ograniczone i opierają się w głównej mierze na opinii ekspertów
Twardzina układowa (systemic sclerosis, scleroderma) należy do heterogennej grupy chorób tkanki łącznej związanych z włóknieniem na podłożu autoimmunologicznym. Charakteryzuje się włóknieniem skóry oraz narządów wewnętrznych. Zmiany występujące w jej przebiegu dotyczą śródbłonka oraz nacieków okołonaczyniowych. Zarówno nieprawidłowa reaktywność, jak i przebudowa drobnych naczyń prowadzą do rozwoju objawu Raynauda i zmian troficznych skóry (nadżerek i ognisk martwicy).[1,2]
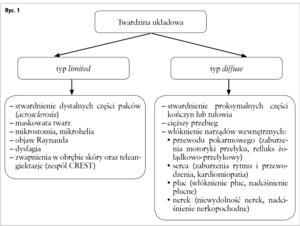
Nomenklatura dotycząca twardziny zmieniała się na przestrzeni ostatnich lat i obecnie, w zależności od powierzchni zajętej skóry, rozróżnia się następujące typy tej choroby:
– twardzina układowa uogólniona, z rozległymi zmianami skórnymi (diffuse systemic sclerosis)
– twardzina układowa ograniczona, z ograniczonymi zmianami skórnymi (limited systemic sclerosis, acrosclerosis)
– morfea – twardzina zlokalizowana/miejscowa
– twardzina układowa bez stwardnienia skóry.[2]
Przebieg i rokowanie twardziny układowej różnią się od siebie w zależności od występującego typu, co przedstawiono na rycinie 1.
Etiologia i patogeneza twardziny układowej jest nieznana. W przebiegu postaci układowej oraz morfea obserwuje się podobną drogę aktywacji immunologicznej i procesów włóknienia, jednak droga przekazywania sygnału genomowego jest odmienna. Mimo że postać morfea może być związana ze znaczną chorobowością, nie obserwuje się istotnego wzrostu śmiertelności w jej przebiegu, podczas gdy postać układowa wiąże się z największym wzrostem śmiertelności wśród wszystkich chorób tkanki łącznej. Badania dotyczące metod leczenia zarówno postaci morfea, jak i układowej, są ograniczone i opierają się w głównej mierze na opinii ekspertów.[1,2,3] Prowadzone obecnie badania wieloośrodkowe być może dostarczą informacji umożliwiających dokładne poznanie etiologii i patogenezy tej choroby, a w konsekwencji umożliwią uzyskanie lepszych efektów terapeutycznych.
Leczenie
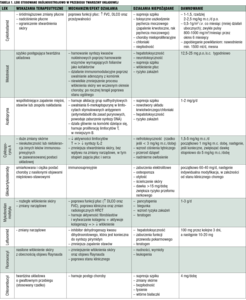
Ze względu na to, że limfocyty T pełnią istotną rolę w patogenezie twardziny układowej, jedną z głównych grup leków stosowanych u chorych z tym schorzeniem są leki immunosupresyjne. Hamują one odkładanie się kolagenu w obrębie skóry i narządów wewnętrznych. W twardzinie układowej stosuje się tzw. leczenie narządowo swoiste (Tabela 1). Niezależnie od stadium choroby każdy chory powinien być monitorowany raz w roku w kierunku śródmiąższowej choroby płuc oraz nadciśnienia płucnego. Wczesne wykrycie i szybko rozpoczęte postępowanie lecznicze mają istotny wpływ na zmniejszenie śmiertelności z powodu tych powikłań.[4] Leczenie nadciśnienia płucnego i śródmiąższowej choroby płuc powinno odbywać się pod kontrolą pulmonologa, jednak w procesie terapeutycznym powinien uczestniczyć zarówno reumatolog, jak i dermatolog.[5] Wydaje się, że u chorych z łagodnym przebiegiem twardziny, bez aktywnych zmian narządowych (nerkowych, płucnych, sercowych), leczenie immunosupresyjne nie jest konieczne.[3]
Ze względu na to, że zaburzenia naczyniowe stanowią element patogenetyczny objawu Raynauda, zmian troficznych skóry, nadciśnienia płucnego, niewydolności nerek, zaburzeń krążenia wieńcowego oraz dysfunkcji przewodu pokarmowego, istotne znaczenie mają leki poprawiające przepływ przez naczynia krwionośne (rycina 2). W przypadku obecności objawu Raynauda w przebiegu postaci miejscowej i uogólnionej lekami pierwszego rzutu są dihydropirydynowe blokery kanału wapniowego (najczęściej nifedypina w dawkach do 20 mg cztery razy dziennie).[6,7,8,9] W przypadku wystąpienia owrzodzeń palców zaleca się podawanie bozentanu w dawce 62,5 mg dwa razy dziennie przez 4 tygodnie, a następnie 125 mg dwa razy dziennie. Ewentualnie można zastosować syldenafil (3 razy dziennie 25 mg) lub iloprost dożylnie.[6,7,8] Jeśli stwardnienie skóry i narządów wewnętrznych postępuje, wówczas wybór leczenia zależy od współwystępujących zmian narządowych (tabela 1). W przypadku towarzyszącego zapalenia mięśni, stawów lub zespołu nakładania zaleca się metotreksat lub azatioprynę.[6,7] Chorzy z obecną chorobą śródmiąższową płuc powinni otrzymać cyklofosfamid.[6,7,8] Jeśli występują tylko zmiany skórne, zaleca się stosowanie mykofenolanu mofetylu lub metotreksatu.[5,6,7,8]
Według opinii ekspertów, leczenie typu morfea powinno być uzależnione od występującego podtypu i aktywności tej choroby (postać aktywna – active morphea oraz nieaktywna – burnt-out morphea), miejsca występujących zmian skórnych oraz współtowarzyszących objawów chorobowych.[9,10] Zaleca się, by postać aktywna z towarzyszącymi zmianami rumieniowatymi lub zmianami rozszerzającymi się była leczona za pomocą miejscowych lub ogólnoustrojowych leków immunosupresyjnych. Postać nieaktywna lub postać morfea w stadium końcowym nie poddaje się leczeniu immunosupresyjnemu.
Ograniczona postać powierzchowna morfea (limited superficial plaque morphea) zwykle dobrze odpowiada na miejscową farmakoterapię oraz fototerapię.[10] Świadczą o tym randomizowane badania kliniczne z grupą kontrolną placebo, które udowodniły skuteczność leczenia takrolimusem podawanym dwa razy dziennie.[11] Z kolei badania prospektywne wykazały korzyści z zewnętrznego podawania imikwimodu stosowanego trzy do pięciu razy w tygodniu.[12] Takrolimus jest inhibitorem kalcyneuryny, który wiąże się ze specyficzną cytoplazmatyczną immunofiliną (FKBP12) i hamuje zależną od wapnia kaskadę przenoszenia sygnałów w limfocytach T. Dzięki temu zapobiega transkrypcji oraz syntezie prozapalnych interleukin (IL-2, IL-3, IL-4, IL-5) oraz cytokin (GM-CSF, TNF-α i IFN-γ). Lek ten hamuje uwalnianie mediatorów zapalenia z komórek tucznych skóry, bazofili i eozynofili. Z kolei imikwimod jest związkiem należącym do grupy aminochinolin, który moduluje odpowiedź immunologiczną przez pobudzanie makrofagów i monocytów do syntezy interferonu α i cytokin (głównie IL-12 i TNF-α).[11,12]