Immunoterapia
Obecnie immunoterapia w przerzutowym czerniaku jest standardem postępowania w I linii leczenia u chorych niezależnie od statusu BRAF2. W terapii stosuje się przeciwciała monoklonalne hamujące punkty kontrolne układu immunologicznego – anty-CTLA-4 (ipilimumab) oraz anty-PD-1 (niwolumab, pembrolizumab). U pacjentów z mniejszą dynamiką choroby, w stanie sprawności uniemożliwiającym zastosowanie terapii dwulekowej, obciążonych chorobami towarzyszącymi, a także bez zajęcia ośrodkowego układu nerwowego (OUN) preferowanym schematem leczenia jest monoterapia przeciwciałami anty-PD-1. U chorych w młodym wieku, bez schorzeń towarzyszących oraz z zajęciem OUN, a także u pacjentów z szybkim nawrotem choroby po leczeniu miejscowym i u chorych progresujących w trakcie leczenia/po leczeniu uzupełniającym czerniaka wybór częściej pada na dwulekową blokadę immunologiczną (niwolumab z ipilimumabem)3,4. Wyniki leczenia skojarzonego ipilimumabem i niwolumabem są również lepsze przy obecności mutacji BRAF. Po 5 latach przeżycia całkowite w ramieniu skojarzonym wyniosły 52% (czyli mediana przekroczyła 60 miesięcy) w porównaniu z 44% dla monoterapii niwolumabem. Leki te podaje się we wlewie dożylnym w odstępie 2-6 tygodni (szczegółowy schemat podawania w przypadku rozpoznania czerniaka można znaleźć w charakterystyce produktu leczniczego). Po niepowodzeniu terapii I linii, w II linii można zaproponować choremu udział w badaniach klinicznych lub chemioterapię. U osób z przerzutami do mózgowia należy jednocześnie rozważyć leczenie miejscowe: neurochirurgiczne lub poprzez napromienianie zmian OUN (stereotaksja, radiochirurgia).
Immunoterapia powoduje modyfikacje w układzie odpornościowym. Jest to zjawisko, które można odczytywać zarówno w kategoriach zalety (efekt działania terapeutycznego utrzymuje się po zaprzestaniu leczenia), jak i wady (ewentualne immunologiczne działania niepożądane mogą postępować mimo zaprzestania terapii, niezależnie od aktywnego leczenia, nawracać podczas redukcji steroidoterapii lub nie reagować na leczenie immunosupresyjne).
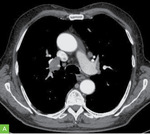
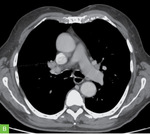
Przykład odpowiedzi na leczenie u chorego na czerniaka w stadium rozsiewu do węzłów chłonnych śródpiersia i kości przedstawiono na rycinie 2. Widoczne jest zmniejszenie zmiany węzłowej w śródpiersiu po stronie prawej po czterech kursach monoterapii anty-PD-1 (wyjściowo wymiary 36 × 27 mm, po 4 kursach anty-PD-1 – wymiary 21 × 20 mm). Inne zmiany mierzalne u opisanego chorego również uległy zmniejszeniu.
Rycina 2A, B. Zmiany węzłowe w śródpiersiu po stronie prawej: A – przed rozpoczęciem leczenia (luty 2022 r.); B – po czterech kursach leczenia anty-PD-1 (maj 2022 r.)
Leczenie celowane inhibitorami BRAF i MEK
W ramach programu lekowego w zaawansowanym czerniaku, a także w leczeniu uzupełniającym czerniaka z obecnością mutacji BRAF są stosowane (zarówno w pierwszej, jak i w kolejnych liniach leczenia) leki ukierunkowane molekularnie – inhibitory kinaz BRAF i MEK5. W Polsce dostępne połączenia to enkorafenib z binimetynibem, dabrafenib z trametynibem i wemurafenib z kobimetynibem.
Podstawą do wybrania danej kombinacji lekowej dla konkretnego pacjenta jest różnorodny profil toksyczności leków6 (np. występujące częściej gorączki przy stosowaniu dabrafenibu z trametynibem, toksyczność skórna i fototoksyczność po zastosowaniu wemurafenibu z kobimetynibem lub powikłania z przewodu pokarmowego po enkorafenibie i binimetynibie). Wszystkie połączenia leków z tej grupy mogą też wywoływać powikłania oczne: retinopatię surowiczą, zapalenie błony naczyniowej oka. U osób, które odpowiadają na zastosowaną terapię, leki powodują szybką poprawę stanu ogólnego, mają korzystny profil bezpieczeństwa, jednak oporność na leczenie pojawia się stosunkowo szybko, a odpowiedź kliniczna po zaprzestaniu terapii nie utrzymuje się długo.
Na korzyść leczenia inhibitorami BRAF i MEK przemawia zazwyczaj odwracalność działań niepożądanych, a także możliwość reindukcji leczenia celowanego. Doustna forma podaży leku przez chorego może być również istotnym kryterium wyboru u niektórych pacjentów. Kombinacje lekowe nie były ze sobą porównywane bezpośrednio, jednak dostępne badania rejestracyjne zdają się wskazywać na podobną skuteczność powyższych połączeń. Wydaje się, że nieco lepsze efekty leczenia w zakresie przeżyć wolnych od progresji choroby i całkowitych uzyskuje się u osób leczonych enkorafenibem z binimetynibem. Wymienione wyżej leki są w Polsce refundowane w ramach programów lekowych.
Istotnym dylematem w praktyce klinicznej jest sekwencja leczenia u chorych na przerzutowego czerniaka z obecnością mutacji BRAF. Z uwagi na możliwość uzyskania długotrwałych odpowiedzi bez konieczności ciągłej terapii preferowaną opcją w I linii leczenia jest immunoterapia. Jej wybór potwierdzają wstępne wyniki prospektywnych randomizowanych badań: SECOMBIT (SEquential COMBo Immuno and Targeted therapy study) i DREAMseq (Doublet, Randomized Evaluation in Advanced Melanoma Sequencing), które wskazują na większą korzyść ze stosowania niwolumabu z ipilimumabem w I linii leczenia7,8. Pomocą w wyborze terapii adekwatnej dla danego pacjenta mogą być czynniki rokownicze, choroby współistniejące (w tym ciężkie choroby autoimmunologiczne), dynamika procesu nowotworowego (szybszy efekt kliniczny po zastosowaniu inhibitorów BRAF i MEK), a także potencjalne działania niepożądane leczenia. Warto również w indywidualnych przypadkach rozważyć włączenie chorego do badania klinicznego.
Radioterapia paliatywna
W trakcie leczenia systemowego należy także pamiętać o możliwości napromieniania zmian przerzutowych lub pierwotnych, które nie reagują na leczenie bądź wywołują silne dolegliwości bólowe.
Profil bezpieczeństwa. Kontrola działań niepożądanych stosowanych terapii
Immunoterapia, w związku ze swoim mechanizmem działania, może powodować wystąpienie powikłań o charakterze autoagresji, dotyczących praktycznie każdego narządu. W celu ich jak najszybszego wykrycia przed każdym podaniem leku poza badaniem podmiotowym i przedmiotowym wykonuje się oznaczenia laboratoryjne (m.in. morfologia, jonogram, transaminazy, tyreotropina, wolna tyroksyna, troponiny) oraz badanie elektrokardiograficzne (w ośrodku autorów rutynowo przy pierwszych kursach leczenia). Najczęstszym działaniem niepożądanym (irAE – immune-related adverse event) jest toksyczność skórna (począwszy od zwiewnych wysypek do erytrodermii, przez pęcherzycę, aż po zespół Stevensa-Johnsona). Leki z tej grupy mogą powodować endokrynopatie (najczęściej zaburzenia funkcji tarczycy o charakterystycznym przebiegu od nadczynności do niedoczynności gruczołu), osłabienie, bóle mięśni i stawów (w ekstremalnych przypadkach mogące skutkować rabdomiolizą), hepatotoksyczność (hipertransaminezemia, cholestaza). Rzadkimi, ale potencjalnie śmiertelnymi powikłaniami, są: toksyczność kardiologiczna (najczęściej przy pierwszych kursach leczenia), płucna (autoimmunologiczne zapalenie płuc wymagające różnicowania z infekcją lub progresją choroby podstawowej), zapalenie mózgu. Często obserwowane jest zapalenie jelita grubego (głównie po zastosowaniu ipilimumabu) objawiające się biegunką nawet do kilkunastu wypróżnień na dobę (wówczas pomocnym badaniem do oceny rozległości zmian oraz diagnostyki różnicowej jest kolonoskopia). Skojarzona terapia anty-CTLA-4 + anty-PD-1 wiąże się z nasileniem działań niepożądanych i powikłań. Wystąpienie toksyczności w stopniu III/IV wg CTCAE (Common Terminology Criteria for Adverse Events), stwierdzanej u ok. 60% chorych, często skutkuje koniecznością wstrzymania leczenia oraz włączenia steroidoterapii, a w szczególnie opornych przypadkach infliksymabu lub mykofenolanu mofetylu.
Immunoterapii nie stosuje się u pacjentów cierpiących na ciężkie choroby z autoagresji o potencjalnie śmiertelnym przebiegu (np. toczeń rumieniowaty układowy, zapalenie naczyń). W przypadku ustąpienia objawów toksyczności terapii oraz redukcji dawki glikokortykosteroidu w przeliczeniu na prednizon ≤10 mg można powrócić do immunoterapii.
Podstawowe działania niepożądane leczenia inhibitorami BRAF i MEK przedstawiono we wcześniejszej części tekstu.
Podsumowanie
W ostatnich latach dzięki dostępności terapii systemowych uzyskano znaczącą poprawę wyników leczenia chorych na czerniaka w zaawansowanym stadium. Przyczyniło się do tego szerokie zastosowanie immunoterapii oraz inhibitorów BRAF i MEK. Niestety wraz z nowymi terapiami pojawiły się też nowe wyzwania w postaci leczenia powikłań immunologicznych bądź działań niepożądanych inhibitorów BRAF i MEK. U chorych na zaawansowanego czerniaka postęp w immunoterapii prowadzi do ciągłego wprowadzania nowych leków, np. skojarzenia anty-PD-1 i anty-LAG-3 (niwolumab z relatlimabem), oraz rozwoju leczenia okołoooperacyjnego. Mimo poprawy wyników leczenia przerzutowego czerniaka konieczne jest dalsze propagowanie profilaktyki pierwotnej wśród społeczeństwa oraz prowadzenie nowych badań klinicznych (w celu dalszej optymalizacji leczenia).