Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Monitorowanie tętna płodu jako badanie przesiewowe
David A. Miller, MD
W kolejnym artykule z serii dotyczącej obalania mitów związanych z monitorowaniem płodu zbadano wartość monitorowania tętna płodu (fetal heart rate, FHR) jako badania przesiewowego.
W tej serii dokonaliśmy przeglądu nazewnictwa związanego z elektronicznym monitorowaniem płodu, szczegółowo przeanalizowaliśmy niektóre powszechne przekonania dotyczące deceleracji, obaliliśmy bezpodstawną teorię dotyczącą śródporodowego ucisku główki płodu oraz zakwestionowaliśmy przekonanie dotyczące wpływu monitorowania płodu na odsetek cięć cesarskich. W tym artykule zbadamy wartość elektronicznego monitorowania płodu jako badania przesiewowego.
Rys historyczny
Elektroniczne monitorowanie płodu (electronic fetal monitoring, EFM) zostało wprowadzone do praktyki klinicznej w erze, gdy uważano, że śródporodowa hipoksja jest główną, jeśli nie jedyną, przyczyną uszkodzenia ośrodkowego układu nerwowego, czyli porażenia mózgowego (cerebral palsy, CP). Na podstawie tego założenia EFM stwarzało nadzieję na rozpoznanie śródporodowej deprywacji tlenu u płodu, a wczesna interwencja miała zapobiec CP.
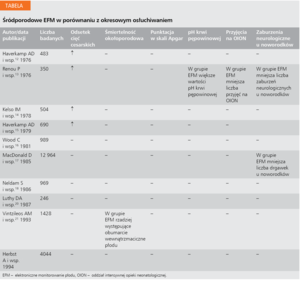
Kiedy EFM zastąpiło w latach 70. XX wieku stosowaną tradycyjnie metodę okresowego osłuchiwania, w serii nierandomizowanych badań donoszono o istotnie mniejszym odsetku śmiertelności okołoporodowej w przypadku stosowania elektronicznego monitorowania.1-11
W przeprowadzonych później badaniach randomizowanych, w których porównano nowe technologie ze stosowanym według ścisłych zasad okresowym osłuchiwaniem, nie udało się jednak wykazać poprawy w okołoporodowej chorobowości i śmiertelności (tabela).12-23
W jednym badaniu w grupie, w której stosowano EFM, zaobserwowano mniejsza liczbę przyjęć na oddział intensywnej opieki i rzadsze występowanie zaburzeń neurologicznych u noworodków.13 Inne badanie wykazało ograniczenie drgawek u noworodków w przypadku stosowania EFM, ale nie odnotowano żadnych odległych korzyści neurologicznych.17,23 Z kolei badanie, przeprowadzone w populacji charakteryzującej się wysokim wskaźnikiem umieralności, wykazało mniejszą liczbę zgonów okołoporodowych w grupie, w której stosowano EFM.21
Jak to tej pory, żadne randomizowane badanie kontrolowane nie potwierdziło pierwotnego założenia, że EFM może zapobiegać CP. Chociaż może to rozczarowywać, nie powinno jednak dziwić w świetle dostępnych dowodów dotyczących patogenezy CP.
W odróżnieniu od pierwotnych założeń, że CP może być następstwem praktycznie tylko skomplikowanego porodu, obecnie wiadomo, że śródporodowa hipoksja jest odpowiedzialna za niewielki odsetek CP. Badania retrospektywne wykazały, że w ponad 90% przypadków CP nie stwierdza się związku z hipoksją w trakcie porodu.24,25 W rezultacie w ponad 9 na 10 przypadków CP nie można oczekiwać, że uda się zapobiec temu powikłaniu lub je rozpoznać dzięki udoskonaleniu postępowania śródporodowego, w tym interpretacji i prowadzenia EFM.
Kiedy CP wybiera się jako punkt końcowy badania, czułość i swoistość EFM są małe, co odzwierciedlają również krzywe ROC. Te fakty w połączeniu z błędnym założeniem, że EFM zwiększa odsetek cięć cesarskich, doprowadziły niektórych badaczy do konkluzji, że EFM „zawiodło jako program badań przesiewowych”.26
W poprzednim artykule z tej serii dokonano przeglądu słabych dowodów naukowych na uznawany powszechnie związek między EFM a większym odsetkiem cięć cesarskich. W tym artykule podano w wątpliwość, czy CP jest właściwym parametrem do pomiaru efektywności śródporodowego EFM jako badania przesiewowego.
Badanie przesiewowe wprowadza się w populacji narażonej na coś, czemu można zapobiec w celu wyodrębnienia subpopulacji, w której poziom ryzyka jest na tyle wysoki, że usprawiedliwia zastosowanie interwencji prewencyjnej. W przypadku EFM tym, czemu można by zapobiec, było śródporodowe hipoksemiczne uszkodzenie mózgu płodu w postaci CP.
Według dostępnych danych schorzenie to występuje rzadko. Całkowita częstość występowania CP wynosi około 1-2 na 1000 dzieci.27 Spośród tych przypadków 1 na 10 można powiązać ze śródporodowym niedotlenieniem.24,25 Dlatego częstość występowania CP, które można potencjalnie przypisać niedotlenieniu płodu w trakcie porodu, wynosi około 1-2 na 10 000.
Badanie przesiewowe, które jest stosowane do wykrywania bardzo rzadko występującego powikłania, będzie dawało duży odsetek wyników fałszywie dodatnich. Nie jest niczym zaskakującym, że przy zastosowaniu śródporodowego EFM jako badania przesiewowego w kierunku rzadko występującego powikłania, jakim jest CP związane ze śródporodowym niedotlenieniem, odsetek wyników fałszywie dodatnich jest nieakceptowalnie wysoki, a swoistość mała. Czy jest to nieodłączny problem EFM jako badania przesiewowego? Czy jest to problem wyboru parametru stosowanego do oceny efektywności testu? Odpowiedź na te pytania wymaga realistycznej oceny związku między EFM a dotlenieniem płodu i CP.
Śródporodowe EFM ma na celu ocenę stopnia dotlenienia płodu w czasie porodu. Szlak transferu tlenu ze środowiska do płodu obejmuje płuca matki, serce, naczynia, macicę, łożysko i pępowinę.28 Odzwierciedleniem przejściowego zaburzenia transferu tlenu w jednym lub kilku miejscach szlaku jest obecność zmiennych, późnych lub przedłużonych deceleracji. Znaczne niedotlenienie może wywołać hipoksemiczne uszkodzenie mózgu płodu w postaci CP.
Droga od prawidłowego dotlenienia płodu do hipoksemicznego uszkodzenia jego mózgu wiedzie przez kolejne fizjologiczne zmiany, rozpoczynając się od niedotlenienia płodu (zmniejszona zawartość tlenu we krwi), postępującego do hipoksji tkankowej (zmniejszona zawartość tlenu w tkankach), a następnie do kwasicy tkankowej (metabolizm beztlenowy, akumulacja kwasu mlekowego, zwiększone stężenie jonów wodorowych i niskie pH w tkankach) i wreszcie kwasicy metabolicznej (zwiększone stężenie jonów wodorowych i niskie pH krwi).
W raporcie z konferencji uzgodnień International Cerebral Palsy Task Force i Cerebral Palsy Task Force of the American College of Obstetricians and Gynecologists oraz American Academy of Pediatrics stwierdzono, że istotna kwasica we krwi pobranej z tętnicy pępowinowej (pH <7 i niedobór zasad ≥12 mmol/l) oraz umiarkowana do ciężkiej encefalopatia płodu są kryteriami koniecznymi do rozpoznania ostrego śródporodowego niedotlenienia płodu jako potencjalnej przyczyny CP.28-30
Idąc dalej, związek przyczynowy między śródporodowym EFM a następowym rozwojem CP wymaga co najmniej 4 elementów: 1) śródporodowego zapisu EFM odpowiadającego niedotlenieniu płodu, 2) istotnej kwasicy metabolicznej płodu stwierdzonej w momencie porodu, 3) umiarkowanej do ciężkiej encefalopatii noworodka rozpoznanej w pierwszych dniach życia i 4) ostatecznego rozpoznania CP w pierwszych latach życia. Te 4 elementy wydają się ustalone w porządku chronologicznym i dzielą je minuty bądź lata.