Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Krew matki jako źródło wiedzy na temat płodu w immunopatologii ciąży – stan obecny i perspektywy
Katarzyna Guz, Ewa Brojer
Wprowadzenie
Niezgodność antygenów na powierzchni komórek krwi – krwinek czerwonych, płytek, granulocytów – między matką a płodem może prowadzić do alloimmunizacji, czyli wytworzenia przez matkę przeciwciał niszczących komórki płodu, prowadząc odpowiednio do choroby hemolitycznej płodu/noworodka (hemolytic disease of the fetus and newborn, HDFN), alloimmunologicznej małopłytkowości płodów/noworodków (fetal and neonatal alloimmune thrombocytopenia, FNAIT) czy alloimmunologicznej granulocytopenii noworodków (neonatal alloimmune neutropenia, NAIN), przy czym ta ostatnia diagnozowana jest rzadko i nie będzie omawiana.
Spośród konfliktów czerwonokrwinkowych najcięższy, najlepiej poznany jest konflikt w antygenie D z układu Rh, który dotyczy kobiet RhD ujemnych. Dla jego ograniczania stosuje się immunoprofilaktykę – po ciąży wszystkim kobietom RhD ujemnym, które urodziły dziecko RhD dodatnie i nie wytworzyły przeciwciał podaje się immunoglobulinę anty-D. Jej skuteczność jest duża, ale niecałkowita (90%) i HDFN z powodu alloimmunizacji antygenem RhD ciągle jeszcze występuje.1-3 Dla zwiększenia skuteczności w wielu krajach immunoprofilaktykę stosuje się też w czasie ciąży, podając immunoglobulinę wszystkim kobietom bez przeciwciał anty-Rh (2-krotnie w 28 i 34 tygodniu ciąży albo jednorazowo w większej dawce w 28/30 tygodniu),4,5 bez względu na to, czy płód jest RhD dodatni, czy ujemny, choć immunoglobulina nie jest potrzebna w tym ostatnim przypadku. Możliwość ustalenia, czy płód jest RhD dodatni, czy ujemny, pozwala na podanie preparatu tylko kobietom z płodem RhD dodatnim.
Inne konflikty czerwonokrwinkowe, w wyniku których dochodzi do wytwarzania alloprzeciwciał, też mogą prowadzić do HDFN.6 Ocena zagrożenia chorobą musi uwzględniać swoistość przeciwciał. Niektóre z nich występują często, ale nie prowadzą do HDFN. Inne, przede wszystkim anty-c, anty-E i anty-K, mogą powodować ciężką HDFN.3
Wśród konfliktów płytkowych, wywołujących FNAIT, najcięższym i najpowszechniej występującym jest konflikt w układzie HPA1a (75-90% przypadków), gdy kobieta HPA1a ujemna wytwarza przeciwciała wobec antygenu HPA1a.7 Rozważane jest prowadzenie badań przesiewowych w kierunku wykrywania konfliktu HPA-1a w czasie ciąży.8 Są też pierwsze doniesienia o próbach opracowania immunoprofilaktyki tego konfliktu.9
Badanie przeciwciał przeciwko antygenom krwinek czerwonych lub płytek u ciężarnej stanowi podstawę diagnostyki w immunopatologii ciąży – kobieta z przeciwciałami musi być objęta specjalistyczną opieką.6 Wykrycie przeciwciał nie musi jednak świadczyć o tym, że płód jest zagrożony chorobą. Przeciwciała mogą bowiem być wynikiem poprzedniej ciąży lub immunizacji po przetoczeniu krwi. Nie są one groźne dla płodu, jeśli nie nosi on antygenu, przeciwko któremu są skierowane. W wyniku ciąży, nawet wtedy, gdy płód jest zgodny z matką pod względem antygenowym, może dojść do nieswoistej stymulacji i zwiększenia stężenia przeciwciał.
Możliwość ustalenia, jakie antygeny ma płód, jest bardzo ważnym badaniem diagnostycznym w przypadkach wykrycia u matki przeciwciał o znaczeniu klinicznym. Takie badania do niedawna można było wykonać jedynie za pomocą technik serologicznych lub molekularnych z materiału pobranego w sposób inwazyjny – z krwi pępowinowej pobranej w wyniku kordocentezy lub amniocytów płynu owodniowego pobranego podczas aminiopunkcji. Obie te procedury wiążą się z ryzykiem utraty płodu, a dodatkowo, co jest bardzo ważne dla kobiet, które wytworzyły przeciwciała, wiążą się z dużym ryzykiem stymulacji organizmu matki do wytwarzania przeciwciał, także do rozszerzania zakresu tych przeciwciał i wytwarzania ich przeciwko innym antygenom, które występują u płodu, ale nie u matki.10
W ostatnich latach opracowano i wdrożono nieinwazyjne metody określania genotypu płodu z DNA izolowanego z osocza ciężarnej – czyli z materiału pobranego całkowicie nieinwazyjnie.11,12 Metoda ta jest stosowana do badań diagnostycznych w konfliktach matczyno-płodowych,13,14 jest też użyteczna dla badań przesiewowych, kwalifikujących kobiety do śródciążowego podania immunoglobuliny anty-D tylko w przypadkach, w których płód jest RhD dodatni (tab. 1).15-17

Tabela 1. Choroby płodu i noworodka wynikające z alloimmunizacji matki antygenami komórek krwi płodu
Celem obecnego opracowania jest przedstawienie metod badań nieinwazyjnych genów płodu w diagnostyce konfliktów serologicznych, dostępnych też w Polsce. Przedstawimy także perspektywy udoskonalania technik badań nieinwazyjnych i ich zastosowań w innych wskazaniach klinicznych niż immunopatologia ciąży, w których istnieje potrzeba wykonywania badań prenatalnych.
Nieinwazyjne badanie genów płodu w DNA izolowanym z osocza ciężarnej – ich zastosowanie w immunopatologii ciąży w Polsce i na świecie
W 1997 roku Lo i wsp. stwierdzili, że w osoczu ciężarnej krąży DNA płodowe (cell free fetal DNA, cff-DNA).12 Stanowi 3-6% DNA izolowanego z osocza, jest wykrywalne już w 5-7 tygodniu ciąży, jego stężenie zwiększa się w trakcie ciąży i bardzo szybko zanika po porodzie.18-19 Wynik badania genów obecnych w tym DNA dotyczy więc aktualnej ciąży. Analiza cff-DNA, mimo niewielkiej jego ilości, jest możliwa m.in. dzięki technice PCR w czasie rzeczywistym (real time PCR).11,14,20 Badanie jest dwuetapowe: po izolacji DNA z osocza wykonujemy badanie za pomocą starterów i sond swoistych dla allelu genu kodującego odpowiedni antygen płodu, który nie występuje u matki (np. antygen RhD, Rhc, K czy HPA1a). Wynik dodatni tego badania wskazuje, że płód jest dodatni i przeciwciała obecne u matki są dla niego groźne. W tych przypadkach, w których wynik pierwszego badania był ujemny, należy wykonać kolejne badanie, aby udowodnić, że ten ujemny wynik nie jest spowodowany względami technicznymi (np. degradacja cff-DNA lub za mała jego ilość w próbce). Dla płodów płci męskiej dowód obecności DNA płodowego stanowi wykrycie genu z chromosomu Y (bo ten chromosom nie występuje u kobiet). W pozostałych przypadkach musimy wykonać wieloetapowe badania, szukając polimorfizmu/genu, który nie występuje u badanej kobiety, ale który dziecko odziedziczyło od ojca. Przedstawiona wyżej zasada badań jest analogiczna dla całej diagnostyki, w której szuka się w osoczu ciężarnej alleli/genów płodu.13,21,22
Dla różnych alleli/genów stopień trudności badania jest jednak różny.11,13 Najprostsze technicznie, a więc najczęściej stosowane, jest wykrywanie w osoczu ciężarnej genów, które u niej nie występują – np. genów z chromosomu Y i genu RHD, którego nie ma kobieta RhD ujemna. Przy badaniu antygenu RhD płodu napotyka się jednak trudności wynikające z różnorodnego podłoża fenotypu RhD ujemnego u różnych ludzi.24-26 W około 1% przypadków kobiet populacji kaukaskiej badanie nie jest możliwe, ponieważ u kobiety RhD ujemnej występuje gen RHD lub jego fragmenty maskujące obecność genu RHD płodu.13,26-28 Taki wariant genu RHD matki może nie ulegać ekspresji (jest gen, ale nie ma białka RhD) albo powstaje białko RhD o obniżonej ekspresji (tzw. D słabe oraz DEL) lub pozbawione części epitopów (tzw. D częściowe), niewykrywane w rutynowych badaniach serologicznych (część matek z takim wariantem RHD może ulec immunizacji antygenem D). Odsetek kobiet RhD ujemnych z wariantem RHD jest znacznie większy w rasach negroidalnej i żółtej, gdzie powszechnie występuje tzw. pseudogen RHDΨ lub hybrydy genów RHD-RHCE, zawierające dużą część sekwencji genu RHD, ale podobnie jak w przypadku pseudogenu RHDΨ, nieinicjujące powstawania białka RhD.23 Jeśli taki wariant RHD będzie obecny u dziecka matki RhD ujemnej, to wynik badania będzie fałszywie dodatni, wykryjemy bowiem gen płodu, który nie tworzy białka RhD. Płód będziemy traktować jako zagrożony chorobą hemolityczną, choć takiego zagrożenia nie ma. Dla monitorowania wyżej wymienionej zmienności genetycznej konieczne jest badanie kilku fragmentów genu RHD i przyrównywanie poziomów ich wykrywania (bądź wykrycia braku fragmentu) do poziomu genu kontrolnego, dzięki czemu możliwe jest identyfikowanie obecności wariantów RHD u matki lub płodu.13
Groźniejsza jest sytuacja, w której wynik badania jest fałszywie ujemny – genu RHD nie wykrywamy, choć występuje u płodu. Może to prowadzić do zaniechania procedur, które są konieczne dla monitorowania ciąży i leczenia płodu. Wynik fałszywie ujemny może być spowodowany niewystarczającym stężeniem lub degradacją cff-DNA w próbce. Wykonanie badań potwierdzających jego obecność uwiarygodnia wynik. Często jednak zachodzi potrzeba wykonania badania z ponownie pobranej próbki.
Oznaczanie antygenu RhD płodu na podstawie analizy cff-DNA obecnego w osoczu RhD ujemnej kobiety stosowane jest nie tylko jako badanie diagnostyczne u kobiet immunizowanych, ale też jako badanie kwalifikujące RhD ujemne kobiety do śródciążowego podania immunoglobuliny anty-D, przeciwdziałającej powstawaniu przeciwciał anty-D. Taka procedura jest obecnie wdrożona w Danii,15 Holandii16 i Szwecji.17 Ustalenie, że płód kobiety RhD ujemnej jest też RhD ujemny, a kobiecie nie trzeba podawać immunoglobuliny, pozwala na znaczące oszczędności (około 40%) deficytowego preparatu immunoglobuliny anty-D i przy wprowadzeniu masowych badań jest ekonomicznie uzasadnione.13
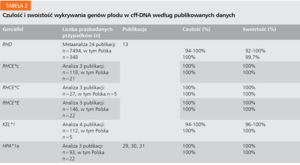
Badania nieinwazyjne są też możliwe i są rutynowo wykonywane w innych konfliktach – w celu wykrywania innych antygenów krwinek, takich jak Rhc, RhC, RhE czy K.13,14,22,27 W trakcie opracowywania jest obecnie diagnostyka antygenu HPA1a.29,30,31
Analizę czułości i swoistości badań nieinwazyjnych w immunopatologii ciąży wykonywanych na świecie i w Polsce przedstawiono w tabeli 2. Jedynym, jak dotąd, ośrodkiem w Polsce jest Pracownia Genetyki Komórek Krwi i Chimeryzmu Instytutu Hematologii i Transfuzjologii w Warszawie, gdzie można wykonać następujące badania:13,21,22