Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Ze względu na wpływ na układ krążenia chemioterapeutyki można podzielić na leki wywołujące zaburzenia rytmu i przewodzenia, o działaniu kardiodepresyjnym, powodujące zarówno nadciśnienie tętnicze, jak i hipotensję oraz prowadzące do niedokrwienia mięśnia sercowego, zapalenia mięśnia sercowego lub osierdzia, a także takie, które sprzyjają incydentom zakrzepowo-zatorowym [14,15].
Prawdopodobieństwo wystąpienia powikłań, w tym powikłań ze strony układu krążenia, zależy m.in. od ciężkości przebiegu choroby podstawowej i w związku z tym konieczności stosowania mniej lub bardziej agresywnej chemioterapii. Przykłady niekorzystnego działania leków na układ krążenia obrazuje tabela 4 [14].
Antracykliny
Grupa ta zajmuje ważne miejsce w najczęściej stosowanych schematach chemioterapii chłoniaków złośliwych nieziarniczych z komórek B oraz chemioterapii innych nowotworów (raka piersi, jajnika, drobnokomórkowego raka płuc). Antracykliny należą do najlepiej przebadanych chemioterapeutyków. Ich toksyczność zależy w dużym stopniu od zastosowanej dawki i wrażliwości osobniczej danego chorego. W przeszłości opisano wiele czynników ryzyka wystąpienia kardiomiopatii poantracyklinowej, do których zalicza się m.in. dawkę kumulacyjną, wcześniejszą lub planowaną radioterapię w obrębie klatki piersiowej, wcześniejsze przyjmowanie innych leków kardiotoksycznych (trastuzumab, cyklofosfamid, 5-fluorouracyl), wiek (<4 r.ż. i >65 r.ż.), choroby współistniejące, rasę czarną, zespół Downa [16]. Współczesne poglądy omawiają znaczenie indywidualnej predyspozycji.
Jednym z patomechanizmów kardiotoksyczności antracyklin jest powstawanie wolnych rodników, które zaburzają metabolizm żelaza w komórkach, a zwiększone stężenie toksycznej frakcji wolnego żelaza indukuje apoptozę kardiomiocytów, przyczyniając się stopniowo do rozwoju kardiomiopatii. Wynikiem jest upośledzenie funkcji skurczowej i rozkurczowej oraz postępujące zwykle nieodwracalne uszkodzenie mięśnia sercowego [17]. Po leczeniu antracyklinami zagrożenie rozwojem zastoinowej niewydolności serca wynosi według niektórych danych do 16%, a przebiegającej bez objawów klinicznych kardiomiopatii nawet do 57% [18]. Prawdopodobieństwo trwałego uszkodzenia serca wzrasta gwałtownie po przekroczeniu łącznej dawki antracyklin wynoszącej dla doksorubicyny 550 mg/m2 (450 mg/m2, gdy występuje inny czynnik ryzyka), dla daunorubicyny 600 mg/m2, epirubicyny 1000 mg/m2, asorubicyny 1900 mg/m2, aklarubicyny 2000-3000 mg/m2, a dla mitoksantronu 160 mg/m2 [16].
Kardiotoksyczność antracyklin może mieć charakter ostry, podostry lub przewlekły. Objawy ostrego uszkodzenia serca występują w ciągu 24 godzin od podania leku, nie zależą od jego dawki, mogą ujawnić się w postaci zaburzeń rytmu, nieprawidłowości w zapisie EKG, zawału mięśnia sercowego, zapalenia osierdzia i mięśnia sercowego, obrzęku płuc i hipotensji, a nawet nagłego zgonu. Postać podostra pojawia się w pierwszym roku leczenia i jest wynikiem trwałego uszkodzenia kardiomiocytów. Objawia się najczęściej niewydolnością serca, ale mogą pojawić się również zaburzenia rytmu i niedokrwienie mięśnia sercowego.
Polskie wieloośrodkowe badanie, przeprowadzone przez Jurczaka i wsp., dowodzi, że wśród chorych na chłoniaki otrzymujących standardową chemioterapię z wykorzystaniem antracyklin jatrogenna niewydolność serca jest drugą przyczyną zgonu wśród tych chorych. Statystycznie co trzeci Polak z chłoniakiem leczony antracyklinami umiera z powodu niewydolności serca [19].
Przewlekłe uszkodzenie serca ujawniające się po 12 miesiącach od ostatniego kursu chemioterapii wiąże się z włóknieniem mięśnia sercowego i ściśle zależy od dawki leku. Rozwijająca się kardiomiopatia rozstrzeniowa objawia się zaburzeniami funkcji skurczowo-rozkurczowej i zaburzeniami rytmu [16,20]. Dane z piśmiennictwa i obserwacje własne wskazują, że przewlekła tzw. odległa kardiotoksyczność może pojawić się nawet wiele lat od zakończenia leczenia antracyklinami. Według niektórych danych późna odległa kardiotoksyczność antracyklin stanowi trzecią przyczynę zgonu w niektórych grupach chorych.
Pewną alternatywą w celu zminimalizowania ryzyka powikłań kardiologicznych jest stosowanie liposomalnej doksorubicyny (zarejestrowanej w terapii przerzutowego raka piersi, a we Włoszech w terapii chłoniaków) lub pegylowanej liposomalnej doksorubicyny (zarejestrowanej w terapii szpiczaka, raka jajnika i piersi). Skuteczność przeciwnowotworowa jest porównywalna, a ryzyko niewydolności serca kilkukrotnie mniejsze, co wynika z farmakodynamiki leku, jego bardziej celowanego działania na tkanki patologiczne, a mniejszego oddziaływania na tkanki zdrowe, w tym mięsień sercowy [21-23].
Leki alkilujące
Przedstawicielami leków alkilujących stosowanych w leczeniu chłoniaków nieziarniczych są cyklofosfamid, ifosfamid, melfalan, bendamustyna. Za kardiotoksyczność cyklofosfamidu odpowiedzialne są jego aktywne biologicznie metabolity, czyli 4-hydroksy-cyklofosfamid, o-karboksyetylo-iperyt azotowy, deschloroetylo-cyklofosfamid, 4-keto-cyklofosfamid i hydroksypropylo-iperyt azotowy [24]. Kardiotoksyczność cyklofosfamidu może objawiać się nieprawidłowościami EKG pod postacią niskiego woltażu załamków QRS, postępującą niewydolnością mięśnia sercowego (7-28%) [25] lub zapaleniem mięśnia sercowego z zajęciem osierdzia. W skrajnych przypadkach zapalenie osierdzia prowadzić może do tamponady serca, wymagającej pilnej perikardiocentezy. W większości przypadków (90%) toksyczny wpływ cyklofosfamidu na mięsień sercowy nie prowadzi do istotnych klinicznie objawów, ponieważ toksyczność ujawnia się najczęściej przy dużych dawkach leku, zazwyczaj w przypadku przygotowywania chorego do przeszczepu szpiku [24].
Ifosfamid, strukturalny izomer cyklofosfamidu, również nie jest pozbawiony działań niepożądanych. W trakcie jego stosowania mogą wystąpić zaburzenia rytmu pod postacią tachykardii nadkomorowej, migotania lub trzepotania przedsionków, pojawić się mogą złośliwe postacie arytmii komorowych. Ponadto obserwuje się niespecyficzne zmiany odcinka ST-T. Przyczyną zaburzeń rytmu mogą być zaburzenia elektrolitowe (hipokaliemia) obserwowane w trakcie leczenia tym cytostatykiem. Zastoinowa niewydolność krążenia (od łagodnego zastoju w krążeniu płucnym do wstrząsu kardiogennego) występuje po 6 do 23 dniach od rozpoczęcia terapii. Poprawę stwierdza się po około tygodniu od odstawienia cytostatyku i po włączeniu leków stosowanych w niewydolności krążenia. Tamponada serca lub wysięk w worku osierdziowym występują bardzo rzadko [24].
Alkaloidy barwinka różowatego (Vinca rosea)
Leki te należą do grupy leków antymikrotubulinowych o właściwościach antymitotycznych. Wiążąc się z tubuliną, zapobiegają tworzeniu mikrotubulin, czyli białek niezbędnych do powstawania wrzeciona mitotycznego [13,26]. Do alkaloidów barwnika różowatego zalicza się: winkrystynę, winblastynę oraz ich półsyntetyczne pochodne – windezynę i winorelbinę. Są stosowane w leczeniu skojarzonym wielu chorób nowotworowych układu krwiotwórczego, w tym chłoniaków nieziarniczych. Charakterystycznym objawem niepożądanym tej grupy leków jest neurotoksyczność, która dotyczy zarówno układu nerwowego autonomicznego, jak i somatycznego. Uszkodzenie autonomicznego układu nerwowego przez alkaloidy może być przyczyną hipotensji upośledzającej przepływ przez naczynia wieńcowe, co klinicznie manifestuje się bólami dławicowymi. W kilka godzin po dożylnym podaniu leku obserwowano ostre niedokrwienie, a nawet zawał mięśnia sercowego, czasem o bezbólowym przebiegu. Do nasilenia choroby wieńcowej i zawału mięśnia sercowego dochodziło częściej podczas chemioterapii zawierającej winkrystynę u pacjentów wcześniej poddawanych radioterapii okolicy śródpiersia [14,27,28].
Analogi platyny
Cisplatyna i karboplatyna mogą powodować groźne zaburzenia rytmu, wyzwolić ból w klatce piersiowej z podwyższeniem troponin sugerujący ostry zespół wieńcowy. Są to jednak powikłania rzadkie. Dowiedziono, że cisplatyna zwiększa ryzyko powikłań zakrzepowych pod postacią zakrzepicy żył głębokich oraz przyczynia się do wystąpienia zatorowości płucnej [17,25]. Mechanizmami prowadzącymi do powikłań zakrzepowo-zatorowych jest bezpośrednie oddziaływanie leku na śródbłonek, zwiększające jego przepuszczalność oraz interakcje między komórkami śródbłonka a leukocytami i płytkami krwi, co wzmaga reakcję zapalną w ścianie naczyń [17]. Dane z wieloletnich obserwacji wskazują, że kilka lat po zastosowaniu terapii cisplatyną rozwijają się zaawansowane zmiany miażdżycowe w naczyniach wieńcowych, co jest odległą manifestacją uszkodzenia śródbłonka.
Przeciwciała monoklonalne
Wprowadzenie rytuksymabu do leczenia chłoniaków było zdecydowanym postępem w leczeniu tej grupy chorób. Jako przeciwciało monoklonalne w sposób celowany wiąże się z powierzchniowym antygenem CD20 obecnym na komórkach preB i dojrzałych limfocytach B i indukuje ich apoptozę na drodze cytotoksyczności zależnej od przeciwciał oraz aktywacji układu dopełniacza [12]. W połączeniu z chemioterapią wchodzi w skład podstawowego schematu leczenia chłoniaka rozlanego z dużych komórek B (DLBCL) i chłoniaka grudkowego. U około 10% pacjentów po zastosowaniu leku dochodzi do hipotensji oraz skurczu oskrzeli z dusznością i hipoksemią [14]. Sporadycznie w pierwszych godzinach po rozpoczęciu wlewu leku opisywano ciężki zespół uwolnienia cytokin przejawiający się naciekami płucnymi, ostrą niewydolnością oddechową, zawałem mięśnia sercowego, wstrząsem kardiogennym i migotaniem komór [29].
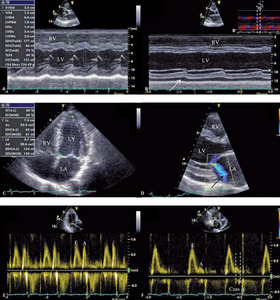
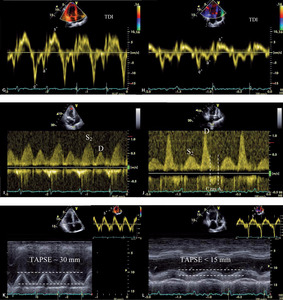
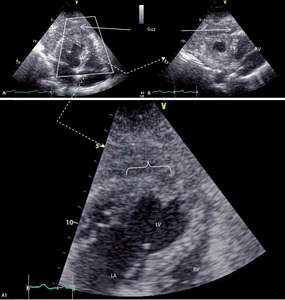
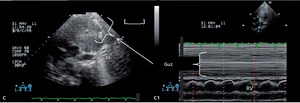
Rycina 3. Echokardiogramy rejestrowane u mężczyzny z podejrzeniem zawału mięśnia serca [A, B] oraz u ciężarnej z podejrzeniem zatoru płucnego [C].