Choroby naczyń
dr hab. n. med. Tomasz Urbanek, Katedra i Klinika Chirurgii Ogólnej i Naczyń SUM, Katowice
Wewnątrznaczyniowe leczenie chorób aorty piersiowej
Wacław Kuczmik
Wprowadzenie
Choroby aorty piersiowej: tętniak, rozwarstwienie ściany, urazowe pęknięcie czy krwiak ściany, są olbrzymim wyzwaniem dla klasycznej chirurgii oraz opieki okołooperacyjnej. Najczęściej do chirurga trafiają pacjenci z tętniakami aorty piersiowej. Częstość ich wykrywania szacuje się na 5,9 przypadków na 100 000 osób na rok. Naturalny rozwój tej choroby prowadzi do stopniowego powiększania się tętniaka i jego pęknięcia, które w 95% przypadków prowadzi do zgonu [1]. Częstość pęknięcia tętniaka większego niż 6 cm szacuje się na ok. 16% w rocznej obserwacji [2]. Ryzyko ostrych stanów aorty – pęknięcia tętniaka lub ostrego rozwarstwienia – to 3,5 na 100 000 osób na rok.
Początek nowoczesnej chirurgicznej terapii chorób aorty piersiowej to połowa ubiegłego wieku. W 1951 r. Lam i Aram po raz pierwszy zaopatrzyli tętniaka piersiowego, rekonstruując aortę za pomocą homograftu. Po zabiegu obserwowano jednak niedowład kończyn dolnych i zapalenie płuc, a po 3 miesiącach chory zmarł [3]. O skutecznym zabiegu chirurgicznym u chorego z patologią w obrębie aorty piersiowej po raz pierwszy donieśli DeBakey i Cooley w 1953 r. [4]. Mimo rozwoju techniki chirurgicznej, wprowadzenia krążenia pozaustrojowego oraz olbrzymiego postępu anestezjologicznego i opieki pooperacyjnej w większości ośrodków chirurgicznych nie udało się uzyskać zadowalających wyników leczenia chirurgicznego tętniaków i rozwarstwienia aorty piersiowej [5-7]. Śmiertelność okołooperacyjna chirurgicznego leczenia tętniaków aorty piersiowej zstępującej jest zróżnicowana – w nielicznych bardzo wyspecjalizowanych ośrodkach wynosi 3-8%, jednak na ogół jest znacznie wyższa i sięga nawet 30% [8,9]. Dlatego poszukuje się metody mniej ryzykownej. Takie założenia wydaje się spełniać leczenie wewnątrznaczyniowe z użyciem stentgraftów. Idea leczenia patologii aorty za pomocą stentgraftu pojawiła się już ponad 20 lat temu i wzbudziła żywe zainteresowanie oraz nadzieję na istotną poprawę wyników leczenia. Volodos w 1986 r. opisał nową metodę leczenia tętniaków aorty z wykorzystaniem wprowadzonej śródnaczyniowo endoprotezy [10,11]. Od tego czasu obserwuje się bardzo szybki rozwój tego sposobu leczenia. Już w 1994 r. Dake przedstawił wczesne i średnio odległe wyniki 13 implantacji stentgraftów w patologii aorty piersiowej zstępującej [12,13]. W 1998 r. w Zabrzu wykonano pierwsze zabiegi wewnątrznaczyniowe na aorcie piersiowej w Polsce [14]. Dokonał tego zespół chirurgów naczyniowych i kardiochirurgów ze Śląska pod kierunkiem prof. Lauterjunga z Monachium. Dwóm chorym z pourazowymi tętniakami aorty piersiowej implantowano stentgrafty specjalnie dla nich skonstruowane. Wydarzenie to otworzyło nowy rozdział naczyniowej medycyny małoinwazyjnej w Polsce.
W pierwszym etapie rozwoju metody stentgrafty były sporządzane indywidualnie dla chorego. W kolejnym były to konstrukcje fabrycznie przygotowane do implantacji. Obecnie w praktyce klinicznej dostępne są kolejne generacje stentgraftów piersiowych, które są łatwe do implantacji i charakteryzują się małą liczbą powikłań zarówno wczesnych, jak i odległych. Obecnie możemy korzystać z kilku konstrukcji: TAG, Valiant, Relay, Zenith TX2 oraz E-Vita 3G.
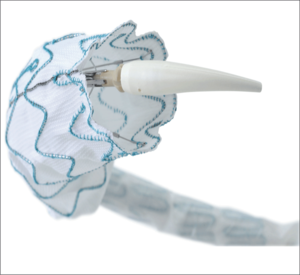
Stentgrafty różnią się budową, materiałem, z którego wykonany jest stent (nitinol, stal), oraz pokryciem (poliester tereftalanu [dakron] lub politetrafluoroetylen [PTFE]), a także mają odmienne systemy dostawcze. Valiant skonstruowany jest na platformie stentu wykonanego z drutu nitinolowego, który obszyty jest ultracienkim dakronem, przy czym pierwszy stent w proksymalnej części jest niepokryty materiałem (ryc. 1). Relay ma podobną budowę, ale całkowicie odmienny system wprowadzania, jego giętkość pozwala łatwo pokonać krzywizny nawet mocno wygiętego łuku aorty (ryc. 2). Zenith TX2 zbudowany jest ze stalowego szkieletu pokrytego dakronem, a stent bez pokrycia znajduje się na końcu dystalnego segmentu stentgraftu. Projektanci stentgraftu TAG wykorzystali nitinolowy szkielet, który zalaminowali PTFE.
Wskazania do implantacji stentgraftów piersiowych
Obecnie rozważa się implantację stentgraftu w przypadku zarówno prawdziwego, jak i rzekomego pourazowego tętniaka aorty piersiowej zstępującej, rozwarstwienia aorty typu B, krwiaka śródściennego aorty, owrzodzenia drążącego ściany aorty, a także urazowego pęknięcia aorty.
Tętniak aorty piersiowej zstępującej
W przypadku tętniaka aorty piersiowej zstępującej wskazaniem do leczenia wewnątrznaczyniowego jest: średnica tętniaka ≥5,5 cm, szybki wzrost średnicy aorty >5 mm w ciągu 6 miesięcy, objawowy charakter tętniaka (ból lub embolizacja obwodowa), pęknięcie tętniaka [15]. Przy planowaniu endowaskularnego leczenia chorób aorty piersiowej istotna jest ocena anatomii tętniaka i dostępu na podstawie badania angio-TK. Do niedawna bardzo dogmatycznie traktowano tzw. strefę lądowania, czyli odcinek prawidłowej aorty do najbliższej dużej tętnicy odchodzącej od aorty (tętnica podobojczykowa, pień trzewny), na którym mocowano stentgraft. Obecnie niekorzystna anatomia tętniaka – brak szyi proksymalnej czy dystalnej – jest coraz rzadziej przyczyną dyskwalifikacji. Decyduje o tym postęp technologiczny, dostępność stentgraftów z odgałęzieniami do istotnych tętnic aorty czy też z fenestrami (otworami) dla pokrywanych tętnic. Należy wskazać na możliwość wykorzystania innych technik implantacji, np. techniki kominowej. Swoje miejsce ma rozwiązanie hybrydowe polegające na zamknięciu stentgraftem tętnic w aorcie lub łuku aorty objętych patologią po wcześniejszej rewaskularyzacji chirurgicznej tych tętnic. Te możliwości sprawiają, że znaczenie anatomii samego tętniaka jest coraz mniejsze. Bardzo ważna jest anatomia dostępu. Średnica i stopień uwapnienia tętnic biodrowych oraz kręty przebieg tych tętnic i aorty może utrudniać, a nawet uniemożliwiać wprowadzenie stentgraftu.
Wewnątrznaczyniowe leczenie, mimo że jest znacznie mniej inwazyjne, nie jest pozbawione ryzyka powikłań. Po implantacji stentgraftu do aorty piersiowej istnieje ryzyko wystąpienia nieszczelności, tzw. przecieku okołooprotezowego (endoleak). Inne istotne powikłania to udar mózgu, porażenie lub niedowład kończyn dolnych spowodowany niedokrwieniem rdzenia, niedokrwienie narządów jamy brzusznej, niewydolność nerek, a także perforacja lub pękniecie aorty czy tętnic biodrowych. Rzadziej obserwuje się wsteczne rozwarstwienie aorty, przetoki aortalno-przełykowe lub aortalno-oskrzelowe [15-17].
Desai i wsp. poddali analizie porównawczej wyniki okołooperacyjne oraz odległe leczenia wewnątrznaczyniowego oraz chirurgicznego tętniaka aorty piersiowej zstępującej [16]. Stu sześciu chorym implantowano stentgraft, a 45 poddano operacji. Chorzy leczeni wewnątrznaczyniowo w tym badaniu byli znacznie starsi oraz mieli więcej czynników ryzyka. Mimo to odnotowana śmiertelność okołooperacyjna wyniosła dla chorych leczonych wewnątrznaczyniowo 2,6%, natomiast dla chorych leczonych operacyjnie 6,7%. Objawy niedokrwienia rdzenia kręgowego z porażeniem lub niedowładem kończyn dolnych wystąpiły odpowiednio u 3,9 i 7,1%. Chorzy po operacji wymagali przedłużonej (powyżej 24 godzin) respiratoroterapii w 24%, podczas gdy po implantacji stentgraftu tylko w 9%. Należy pamiętać, że zabieg wewnątrznaczyniowy może być wykonany w znieczuleniu miejscowym z sedacją farmakologiczną – wtedy ryzyko niewydolności oddechowej po zabiegu jest minimalne. Autorzy podkreślają jednak, na podstawie analizowanego materiału, że wybór metody leczenia nie miał wpływu na przeżycie odlegle chorych po 10 latach obserwacji.
Inni autorzy prospektywnie oceniali leczenie wewnątrznaczyniowe tętniaków aorty piersiowej zstępującej w ośrodku referencyjnym w okresie do 6 lat po implantacji stentgraftów [17]. Leczeniu poddano 297 chorych, wykonując 332 procedury implantacji stentgraftów. W 12% przypadków konieczna była ponowna interwencja, średnio po 8±14 miesiącach. W pierwszym okresie wykonywania tych procedur w ośrodku częstość ponownych interwencji była znacznie większa i wynosiła 15%, natomiast później 9,9%, co potwierdza bardzo istotną rolę doświadczenia i krzywej uczenia. Po 6-letniej obserwacji 84% chorych nie wymagało ponownej interwencji, zaś podstawową przyczyną ponownych zabiegów był przeciek okołoprotezowy typu I aż u 5% pacjentów. Jak się jednak okazało, konieczność ponownej interwencji nie miała wpływu na długość przeżycia.
Metoda wewnątrznaczyniowego leczenia tętniaków aorty piersiowej jest metodą z wyboru dla chorych z akceptowalną anatomią.
Rozwarstwienie aorty typu B
Rozwarstwienie aorty to wytworzenie w ścianie aorty patologicznego światła, tzw. kanału fałszywego, którego średnica najczęściej jest znacznie większa od światła prawdziwego. Rozwarstwienie aorty może prowadzić do upośledzenia ukrwienia narządów lub kończyn oraz stwarza znaczne ryzyko pęknięcia aorty. Typ B rozwarstwienia oznacza, że miejsce wejścia (entry) do kanału fałszywego znajduje się poniżej tętnicy podobojczykowej lewej. Sposób leczenia chorych z rozwarstwieniem aorty typu B zależy od ewolucji rozwarstwienia: ostre (<14 dni), podostre (14-30 dni) i przewlekłe (>30 dni) oraz od utrzymujących się objawów rozwarstwienia, ale także utrzymującego się uporczywego nadciśnienia tętniczego [15]. Najczęściej obserwowane powikłania rozwarstwienia to progresja rozwarstwienia, wzrost średnicy aorty, objawy pęknięcia aorty oraz niedokrwienie narządów.
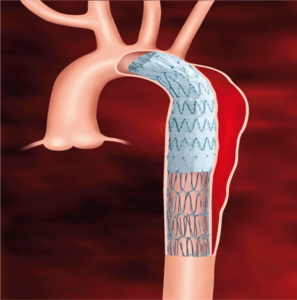
Ideą wewnątrznaczyniowego leczenia rozwarstwienia aorty jest wprowadzenie do kanału prawdziwego stentgraftu i zamknięcie nim miejsca wejścia do kanału fałszywego oraz pokrycie względnie długiego odcinka rozwarstwionej ściany stentgraftem lub stentem, co ma prowadzić do korzystnej przebudowy chorobowo zmienionej aorty (ryc. 3). Problem remodelingu rozwarstwionej aorty piersiowej po leczeniu wewnątrznaczyniowym wydaje się kluczowy dla dalszego rokowania chorego. Kim i wsp. badali przebieg przebudowy rozwarstwienia u chorych z ostrymi objawami po implantacji stentgraftu [18]. W grupie 33 chorych bez przecieku okołoprotezowego po wszczepieniu stentgraftu obserwowano powiększenie się prawdziwego światła po miesiącu u 29%, po roku u 51%, a po 5 latach u 80%. W ślad za tymi zmianami zmniejszała się objętość światła fałszywego odpowiednio u 69, 76 i 86%. Taka korzystna ewolucja rozwarstwienia wydaje się przemawiać za wewnątrznaczyniowym leczeniem rozwarstwienia aorty, zwłaszcza objawowego i w fazie ostrej.
Wątpliwości co do sposobu optymalnego leczenia chorych z przewlekłym rozwarstwieniem bezobjawowym – za pomocą stentgraftu z leczeniem farmakologicznym czy tylko leczenie farmakologicznie – próbowano rozwiać w randomizowanym badaniu INSTEAD [19,20]. Zaskoczeniem były wyniki badania, które pokazały, że nie ma różnicy w śmiertelności w 2-letniej obserwacji w porównywanych grupach. Jednak po implantacji stentgraftu obserwowano korzystną przebudowę ściany aorty u 91,3% chorych, podczas gdy w grupie leczonej farmakologicznie tylko u 19,4%, co może mieć znaczenie przy dłuższej obserwacji.