Kardiologia interdyscyplinarna
Klinika Kardiologii PUM, Szczecin
Ogólnoustrojowy proces zapalny i autoimmunizacja a ryzyko powikłań zakrzepowo-zatorowych u pacjentów z chorobami tkanki łącznej
Wojciech Płazak,1 Piotr Podolec,1 Edyta Płońska-Gościniak,2 Jacek Musiał3
Historia badań
Terminu antykoagulant toczniowy (lupus anticoagulant, LA) użyli po raz pierwszy w 1972 r. Feinstein i Rapaport [1] w opisie inhibitora koagulacji, którego istnienie stwierdzono u niektórych chorych z toczniem rumieniowatym układowym (SLE). Wkrótce okazało się, że antykoagulant toczniowy wykazujący in vitro działanie przeciwkrzepliwe, in vivo może powodować powikłania zatorowo-zakrzepowe. Dzięki dalszym badaniom, w tym opisaniu przeciwciał antykardiolipinowych (aCL) w 1983 r., poznano związek między występowaniem przeciwciał antyfosfolipidowych a epizodami zakrzepowo-zatorowymi. W 1987 r. stworzono termin zespół antyfosfolipidowy [2,3]. Obecnie stosuje się kryteria zespołu zmodyfikowane w 2006 r. [4]. W 1990 r. opisano białko ß2-glikoproteinę I (ß2GPI). Obecność przeciwciał anty-ß2GPI jest również związana ze zwiększonym ryzykiem zatorowo-zakrzepowym.
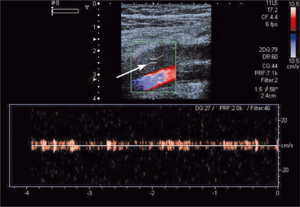
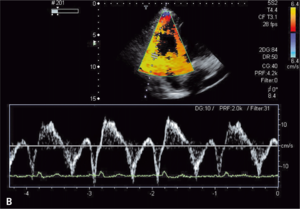
Rycina 3. Podwyższone ciśnienie skurczowe krwi w prawej komorze u chorego z toczniem rumieniowatym
układowym.
Zespół antyfosfolipidowy
Laboratoryjnymi kryteriami rozpoznania zespołu antyfosfolipidowego jest stwierdzenie w surowicy antykoagulantu toczniowego (w dwóch pomiarach wykonanych w odstępie co najmniej 12 tygodni) i przeciwciał antykardiolipinowych lub anty-ß2GPI.
Szczegółowy mechanizm powstawania zakrzepów u chorych z zespołem antyfosfolipidowym nie jest znany. Postuluje się interakcje przeciwciał antyfosfolipidowych z białkiem C i ze składowymi układu dopełniacza, zaburzenie ochronnego przeciwkrzepliwego działania aneksyny A5 oraz aktywację wielu komórek, takich jak płytki krwi, monocyty czy komórki śródbłonka, które zmieniają fenotyp na prozakrzepowy [5]. Wykazano, że u chorych z wysokim mianem przeciwciał antyfosfolipidowych uszkodzenie śródbłonka indukuje istotnie większą produkcję trombiny w porównaniu z osobami bez tych przeciwciał [6].
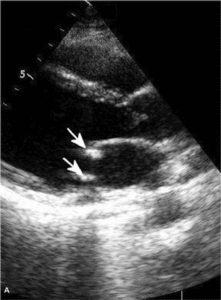
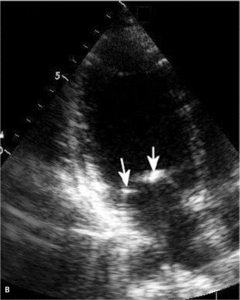
Najczęstszą kliniczną manifestacją zespołu antyfosfolipidowego jest zakrzepica żylna, zwłaszcza żył głębokich kończyn dolnych (ryc. 1). Zakrzepica tętnicza występuje rzadziej i dotyczy głównie tętnic mózgowych (ryc. 2), ale może także dotyczyć tętnic wieńcowych lub innych obszarów naczyń obwodowych [7].
Szczególnie istotne jest zdefiniowanie czynników ryzyka ponownego epizodu zakrzepicy u chorych z rozpoznanym zespołem antyfosfolipidowym. Pierwsza metaanaliza 25 badań wykazała, że najbardziej zagrożeni są chorzy z dodatnim wynikiem badania w kierunku antykoagulantu toczniowego oraz średnim lub wysokim mianem przeciwciał antykardiolipinowych klasy IgG [8]. Nowe badania wykazały, że u chorych z dodatnim wynikiem w kierunku zarówno antykoagulantu toczniowego, jak i przeciwciał przeciwko aCL (LA + aCL IgG)lub anty-ß2GPI (LA + anty-ß2GPI IgG) lub obu tych przeciwciał (LA + aCL IgG + anty-ß2GPI IgG) ryzyko nawrotowych powikłań zakrzepowych jest szczególnie duże [9,10].
Toczeń rumieniowaty układowy
Zwiększone ryzyko zaburzeń zakrzepowo-zatorowych u chorych z toczniem rumieniowatym układowym wynika przede wszystkim z częstej obecności przeciwciał antyfosfolipidowych u tych chorych. W ostatnich badaniach wykazano, że zwiększone stężenie aCL i anty-ß2GPI w klasie IgG powodują wzrost ciśnienia skurczowego w prawej komorze (ryc. 3A, B) [11]. Stwierdzono także większą częstość występowania przeciwciał aCL u chorych z SLE i nadciśnieniem płucnym w porównaniu z chorymi z prawidłowym ciśnieniem w tętnicy płucnej [12]. W innym badaniu chorych z mieszaną chorobą tkanki łącznej (mixed connective tissue disease, MCTD) nadciśnienie płucne było związane ze zwiększonym stężeniem przeciwciał anty-ß2GPI [13]. Podwyższenie ciśnienia skurczowego w tętnicy płucnej związane z występowaniem przeciwciałami aCL może wynikać z mikrozakrzepicy lub mikrozatorowości, która zwiększa opory naczyń płucnych, powoduje wzrost ciśnienia skurczowego w prawej komorze i prowadzi do powiększenia prawej komory. Należy podkreślić, że względne ryzyko zatorowości płucnej u chorych z SLE w pierwszym roku od rozpoznania w porównaniu z populacją ogólną jest bardzo duże i wynosi 10,23 [14].
Opisano ponadto związek zaburzeń perfuzji miokardium u chorych z SLE (uwidocznionych w badaniu SPECT) ze zwiększonymi stężeniami przeciwciał aCL i anty-ß2GPI w klasie IgG [11]. Jest bardzo prawdopodobne, że zaburzenia perfuzji mięśnia serca wynikają u tych chorych z małych, niemożliwych do uwidocznienia za pomocą metod nieinwazyjnych, zakrzepów w mikrokrążeniu wieńcowym. Powodują one powstanie trwałych (spoczynkowych) zaburzeń przepływu krwi w niewielkich obszarach miokardium. Wyniki te są zgodne z danymi z dużego badania 380 chorych z SLE [15], które wykazały, że zwiększone stężenie przeciwciał antyfosfolipidowych wpływało istotnie na ryzyko wystąpienia zawału mięśnia sercowego, a w mniejszym stopniu na obecność klasycznych zmian miażdżycowych (ogniska martwicy mięśnia serca powstawały niezależnie od obecności zmian miażdżycowych, a prawdopodobnym mechanizmem była zakrzepica wewnątrznaczyniowa).
Reumatoidalne zapalenie stawów
Zwiększona śmiertelność wśród chorych z reumatoidalnym zapaleniem stawów wynika przede wszystkim z dużej śmiertelności z przyczyn sercowo-naczyniowych [16,17]. Częstość występowania tradycyjnych czynników ryzyka choroby niedokrwiennej serca u pacjentów z tą chorobą jest nieznacznie większa niż w populacji ogólnej i nie tłumaczy istotnego wzrostu częstości występowania incydentów sercowo-naczyniowych, w tym epizodów zakrzepicy. Istotnym czynnikiem zwiększającym ryzyko jest w tej grupie chorych proces zapalny [18-21]. Wykazano, że wysokie stężenie markerów procesu zapalnego jest niezależnym czynnikiem ryzyka sercowo-naczyniowego [22,23]. Dlatego wytyczne europejskie EULAR (European Ligue Against Rheumatism) [24] w celu oceny ryzyka sercowo-naczyniowego u chorych z reumatoidalnym zapaleniem stawów zalecają użycie standardowych wskaźników ryzyka u danego chorego i pomnożenie ich przez 1,5, zwłaszcza jeśli choroba trwa dłużej niż 10 lat, u chorego wykryto czynnik reumatoidalny lub przeciwciała anty-CCP lub występują u niego objawy pozastawowe choroby.
Względne ryzyko zatorowości płucnej u chorych z reumatoidalnym zapaleniem stawów w pierwszym roku od rozpoznania w porównaniu z populacją ogólną wynosi 5,99 [14].
Profilaktyka i leczenie powikłań zakrzepowo-zatorowych w chorobach tkanki łącznej
Obecnie uważa się, że u chorych z rozpoznanym zespołem antyfosfolipidowym, ale bez zakrzepicy, mimo występowania przeciwciał antyfosfolipidowych nie prowadzi się profilaktyki przeciwzakrzepowej. U chorych z objawami zakrzepicy prowadzi się leczenie zgodnie ze standardami [25]. Także u chorych z toczniem rumieniowatym lub reumatoidalnym zapaleniem stawów stała profilaktyka przeciwzakrzepowa nie jest zalecana.
Wiadomo jednak, że obecność zmian miażdżycowych w tętnicach wieńcowych, ubytki perfuzji widoczne w badaniu SPECT oraz podwyższenie ciśnienia w tętnicy płucnej, obserwowane u dużego odsetka chorych z chorobami tkanki łącznej [11,26], stanowią silne czynniki ryzyka zgonu [27,28]. Prawdopodobny mechanizm mikrozakrzepowy lub mikrozatorowy leżący u ich podstaw u chorych z autoimmunizacją kieruje uwagę badaczy na zapobieganie zakrzepicy u pacjentów bez objawów z wysokim mianem przeciwciał antyfosfolipidowych. Wykazano, że u takich bezobjawowych chorych z przeciwciałami aCL profilaktyka przeciwzakrzepowa za pomocą kwasu acetylosalicylowego lub heparyny drobnocząsteczkowej w okresach zwiększonego ryzyka (zabiegi chirurgiczne, unieruchomienie) skutecznie zmniejsza liczbę powikłań zakrzepowo-zatorowych [29]. Skuteczna w tej grupie chorych jest także pierwotna profilaktyka za pomocą kwasu acetylosalicylowego i hydroksychlorochiny [30,31].