Medyczne kannabinoidy i ich zastosowanie w chorobach neurologicznych
mgr Anna Pierzchlińska1
prof. dr hab. n. med. Anna Machoy-Mokrzyńska2
prof. dr hab. n. med. Monika Białecka1
- W artykule omówiono możliwości zastosowania medycznych kannabinoidów w takich chorobach neurologicznych, jak: stwardnienie rozsiane, padaczka, choroba Alzheimera, choroba Parkinsona oraz bóle neuropatyczne, bóle kręgosłupa i migrena
- Wobec braku silnych rekomendacji dla tej grupy leków wynikającego z małej liczby badań i niskiej jakości dowodów kannabinoidy nie powinny być stosowane jako leki pierwszego wyboru w omawianych w artykule jednostkach chorobowych, a możliwość ich wprowadzenia do leczenia może być rozważona po wyczerpaniu innych schematów terapii bólu neuropatycznego, wybranych objawów stwardnienia rozsianego czy padaczki lekoopornej
Konopie siewne (Cannabis sativa L.) były wykorzystywane w celach medycznych już 3000 lat przed naszą erą jako środek rozkurczowy, przeciwbólowy i przeciwlękowy. W medycynie zastosowanie znalazły 2 podgatunki, tj. konopie siewne (Cannabis sativa sativa) i konopie indyjskie (Cannabis sativa indica). Punktem zwrotnym we współczesnej medycynie było odkrycie w 1964 r. głównej substancji psychoaktywnej konopi – Δ9-tetrahydrokannabinolu (Δ9-THC) – oraz opisanie jej struktury chemicznej. Do tej pory zidentyfikowano ponad 100 fitokannabinoidów pochodzących z konopi, w tym kannabidiol (CBD), kannabigerol, kwas kannabidiolowy, kannabicyklol, kannabichromen, kannabinol i inne. Wyprodukowano również kannabinoidy syntetyczne i tzw. związki kannabinomimetyczne (głównie tzw. dopalacze). Ligandy receptorów kannabinoidowych, receptory CB1 i CB2 oraz enzymy biorące udział w syntezie i degradacji endokannabinoidów wchodzą w skład układu endokannabinoidowego (ECS – endocannabinoid system), inaczej zwanego endokannabinoidowym fizjologicznym układem kontroli (EPCS – endocannabinoid physiological control system). Udział ECS zarówno w procesach fizjologicznych, jak i patofizjologii wielu chorób przyczynił się do licznych prób wykorzystania kannabinoidów w farmakoterapii, w tym w neurologii1,2.
Kannabinoidy – mechanizm działania i wybrani przedstawiciele
Kannabinoidy należą do rodziny meroterpenów, charakteryzują się budową trójcykliczną i są pochodnymi benzopiranu. Działają (w różnym stopniu) na receptory z rodziny sprzężonych z białkiem G (GPCRs – G protein-coupled receptors): receptor kannabinoidowy typu 1 (CB1) i typu 2 (CB2). CB1 jest najbardziej rozpowszechnionym GPCR w ośrodkowym układzie nerwowym (OUN), zwłaszcza w obrębie jąder podstawy, w obszarze zstępującej drogi bólowej czy w płacie limbicznym. Występuje również w wielu tkankach na obwodzie, w przeciwieństwie do receptorów kannabinoidowych typu 2, które poza OUN związane są głównie z komórkami i tkankami układu immunologicznego. Dopiero w latach 90. XX wieku odkryto endogenne ligandy dla wymienionych receptorów: anandamid (AEA) oraz 2-arachidonyloglicerol (2-AG), a także enzymy odpowiedzialne za ich syntezę i degradację. Endokannabinoidy syntetyzowane są na żądanie w odpowiedzi na ból i stres, działając jak endogenne analgetyki. Uważa się, że system endokannabinoidowy bierze udział w procesach takich jak: odpowiedź immunologiczna i zapalna, regulacja apetytu i funkcji przewodu pokarmowego, kontrola funkcji układu sercowo-naczyniowego, odpowiedź na stres, regulacja nastroju, neuroprzekaźnictwa i gospodarki hormonalnej2.
Najczęściej używanymi fitokannabinoidami są Δ9-tetrahydrokannabinol (THC) oraz kannabidiol (CBD) (tab. 1). Oprócz kannabinoidów pochodzenia naturalnego wykorzystuje się także ich syntetyczne odpowiedniki (nabilon, dronabinol), a w badaniach naukowych również substancje o innej strukturze chemicznej, działające jednak na receptory CB1 i CB2 (np. WIN 55,212-2)1. Między dwoma głównymi fitokannabinoidami, tzn. THC i CBD, istnieją różnice farmakodynamiczne. THC jest częściowym agonistą obydwu typów receptorów kannabinoidowych, a jego wiązanie z receptorem jest odpowiedzialne nie tylko za działanie przeciwbólowe, przeciwzapalne, przeciwwymiotne, ale również efekty psychoaktywne.
W artykule zarówno kannabinoidy pochodzenia naturalnego (fitokannabinoidy), jak i syntetycznego, wykorzystywane w farmakoterapii, będą nazywane ogólnie kannabinoidami (CB – cannabinoids).
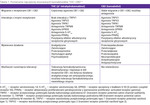
W Polsce weszły w życie kolejne nowelizacje obowiązujących aktów prawnych dotyczących możliwości stosowania kannabinoidów: Ustawa z dnia 20 lipca 2018 r. o zmianie ustawy o przeciwdziałaniu narkomanii (Dz.U. 2018 poz. 1490) oraz Obwieszczenie Marszałka Sejmu RP z dnia 13 stycznia 2022 r. w sprawie ogłoszenia jednolitego tekstu ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych, czego skutkiem było dopuszczenie surowców pochodzących z konopi do celów medycznych, co rozszerzyło dostępne możliwości ich zastosowania. Nadal jednak wiele środków zawierających kannabinoidy dostępnych jest tylko na drodze importu docelowego (tab. 2). Kannabinoidy syntetyczne – nabilon i dronabinol – będące analogami THC, mimo rejestracji w Stanach Zjednoczonych i niektórych krajach europejskich nie są dostępne w Polsce, podobnie jak krople z CBD (Epidiolex) zaakceptowane przez Food and Drug Administration (FDA) i European Medicines Agency (EMA) do stosowania z klobazamem u pacjentów ≥2 roku życia z padaczką w zespołach Dravet i Lennoxa-Gastauta10,11.
Pojawienie się preparatów na bazie fitokannabinoidów i syntetycznych CB zwróciło uwagę lekarzy i samych pacjentów na możliwość ich stosowania w niektórych chorobach neurologicznych. Prawdopodobnie każdy z praktykujących lekarzy neurologów spotkał się z pytaniem o zasadność dołączenia CB do standardowej terapii, np. bólu neuropatycznego, padaczki czy choroby Parkinsona. Kolejną kwestią jest również możliwość refundacji terapii CB. Agencja Oceny Technologii Medycznych i Taryfikacji nie rekomenduje wydawania zgód na refundację środków: Bediol, Bedrocan, Bedrolite, Bedrobinol, Bedica ze wskazań takich jak: padaczka lekooporna, ból przewlekły (w tym neuropatyczny), spastyczność (w tym spastyczność w stwardnieniu rozsianym), algodystrofia, nudności i wymioty związane z chemioterapią czy stwardnienie rozsiane13. Brak rekomendacji wynika z trudności związanych z interpretacją wyników dostępnych badań klinicznych (niska lub średnia jakość dowodów naukowych i substancje o odmiennym składzie używane w dostępnych badaniach klinicznych; Rekomendacja nr 15/2018 z dnia 26 lutego 2018 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji), podczas gdy trudności w podjęciu decyzji na temat włączenia CB do terapii mogą być skutkiem często sprzecznych informacji pojawiających się na różnych stronach internetowych poświęconych kannabinoidom.
Ból neuropatyczny
Ból neuropatyczny definiowany jest jako przewlekły ból spowodowany uszkodzeniem lub chorobą somatosensorycznej części układu nerwowego, niezależnie od pierwotnej przyczyny, którą mogą być np. choroba metaboliczna, infekcja, uraz czy też czynnik nieznany. Ból neuropatyczny dotyczy 0,5-0,8% populacji ogólnej i >20% pacjentów leczonych w poradniach leczenia bólu. Mimo stosowania leków różnych grup (przeciwdepresyjnych, przeciwdrgawkowych, miejscowo znieczulających) skuteczność farmakoterapii bólu neuropatycznego jest ograniczona, nie więcej niż 40-60% pacjentów uzyskuje przynajmniej częściową redukcję dolegliwości14.
Potwierdzony udział systemu endokannabinoidowego w nocycepcji uzasadnia próby stosowania naturalnych lub syntetycznych kannabinoidów w leczeniu bólu, w tym neuropatycznego. Struktury odpowiedzialne za modulację przewodzenia bólu, takie jak rogi tylne rdzenia kręgowego, substancja szara okołowodociągowa czy jądro brzuszne tylno-boczne wzgórza, wykazują średnią lub wysoką gęstość receptorów CB1. Co ciekawe, liczba CB1 w zakresie włókien Aβ i Aδ istotnie przewyższa liczbę receptorów opioidowych μ. W modelach zwierzęcych bólu przewlekłego wykazano wzrost ekspresji receptorów CB1 i CB2, zarówno na poziomie mRNA, jak i białka. Dodatkowo myszy genetycznie pozbawione receptora CB1 (myszy CB1−/−) nie doświadczały efektu antynocycepcyjnego podczas stosowania kannabinoidów4.
Uważa się, że CB mogą działać na różnych poziomach dróg przewodzących czucie bólu, jednak jednym z ważniejszych u ludzi wydaje się szlak czołowo-limbiczny, odpowiedzialny za emocjonalną reakcję na ból. W tym obszarze gęstość receptorów CB1 jest wyjątkowo duża4. Mimo że pierwotnie receptory CB2 kojarzono z komórkami układu immunologicznego, obecnie wiadomo, że występują one także w astrocytach i mikrogleju, zmniejszają uwalnianie czynników prozapalnych i pronocycepcyjnych, tym samym redukują intensywność bólu i reakcję zapalną4,15. Wydaje się, że oba receptory odgrywają istotną rolę w percepcji bólu, przy czym aktywacja receptora CB1 prowadzi do działania euforyzującego, podczas gdy pobudzenie receptora CB2 hamuje przewodzenie sygnału bólowego. Należy pamiętać, że system endokannabinoidowy, zwykle opisywany w kontekście receptorów CB1 i CB2, wywiera wpływ na nocycepcję również przez interakcję niemal ze wszystkimi układami zaangażowanymi w percepcję, przewodzenie i modulację czucia bólu (np. układ noradrenergiczny, opioidowy, GABA-ergiczny i glutaminergiczny). Ponadto CB wpływają na wiele receptorów – np. receptor waniloidowy przejściowego potencjału typu 1 (TRPV1 – transient receptor potential vanilloid type 1), peptyd związany z genem kalcytoniny (CGRP – calcitonin gene-related peptide) czy podjednostkę β2 receptora GABAA15.