Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Ocena narządu wzroku pacjentów z chorobą Parkinsona
lek. Barbara Nowacka, dr hab. n. med. prof. PUM Wojciech Lubiński
Najczęstsze choroby okulistyczne w przebiegu choroby Parkinsona to zespół suchego oka oraz jaskra. Problemem są również halucynacje wzrokowe. Świadomość, które schorzenia okulistyczne towarzyszą tej chorobie, ułatwia ich wczesną diagnostykę i leczenie.
Choroba Parkinsona (PD – Parkinson’s disease) jest jedną z tzw. chorób neurodegeneracyjnych. Charakteryzuje się zaburzeniami motoryki w postaci sztywności mięśniowej, drżenia spoczynkowego, spowolnienia ruchowego oraz zaburzeń stabilności postawy. Przyczyną dolegliwości jest obniżenie stężenia dopaminy w ośrodkowym, jak również obwodowym układzie nerwowym.1 Częstość PD w populacji ogólnej szacowana jest na 0,15% i wzrasta z wiekiem. Wśród osób powyżej 70 r.ż. wynosi nawet 1,5%. Na tej podstawie szacuje się, że w Polsce choruje około 70 tys. osób. W związku ze starzeniem się populacji liczba ta prawdopodobnie wzrośnie do około 110 tys. osób w 2020 roku. PD będzie stanowić coraz większy problem, nie tylko społeczny, ale również ekonomiczny. W Czechach, które mają podobną do polskiej sytuację ekonomiczną i zbliżony system opieki zdrowotnej, koszty bezpośrednie leczenia i opieki nad pacjentami z PD wynoszą średnio 6700 euro, natomiast pośrednie 6000-6600 euro rocznie na pacjenta.2 Wyniki badań wskazują, że największe koszty generuje pobyt pacjentów w zakładach opieki długoterminowej.
Ważnym problemem związanym z PD są upadki oraz halucynacje wzrokowe, które zwiększają prawdopodobieństwo konieczności opieki instytucjonalnej. Halucynacje wzrokowe dotyczą nawet 25% pacjentów.3 Można je podzielić na proste (jak błyski światła czy koloru) oraz złożone (obraz ludzi, zwierząt, przedmiotów). U osób z PD halucynacje mają najczęściej charakter złożony i przedstawiają jeden ruchomy, zamazany obraz, z którym pacjenci często starają się wejść w interakcję.4 Do niedawna sądzono, że halucynacje wzrokowe są jedynie powikłaniem leczenia prekursorem dopaminy – lewodopą. Dalsze badania wykazały jednak, że występują one także u osób, które nie zostały jeszcze poddane żadnemu leczeniu. Czynnikami ryzyka halucynacji wzrokowych są: upośledzenie funkcji poznawczych (demencja), obniżone stężenie dopaminy przed przyjęciem kolejnej dawki leku, upośledzenie fazy REM (rapid eye movement) snu oraz dłuższy czas trwania i bardziej zaawansowane stadium PD. Ważnym czynnikiem ryzyka jest również obniżenie najlepszej ostrości wzroku używanej na co dzień.5 Halucynacje wzrokowe znacznie obniżają jakość życia pacjentów, dlatego tak ważne jest, aby w miarę możliwości eliminować okulistyczne czynniki ryzyka ich wystąpienia. Służy temu dobór odpowiedniej korekcji okularowej oraz leczenie towarzyszących chorób oczu, prowadzących do upośledzenia odbioru bodźców wzrokowych, jak np. zaćma. Dobra funkcja narządu wzroku zmniejsza nie tylko ryzyko halucynacji wzrokowych, ale także częstość upadków.
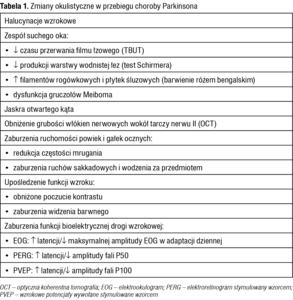
W oku dopamina znajduje się w komórkach amakrynowych A18 wewnętrznej warstwy splotowatej siatkówki, natomiast receptory dopaminergiczne (D1-5) rozproszone są w całej siatkówce oraz ciele rzęskowym.6 Dopamina bierze udział w procesach takich jak adaptacja do światła, poczucie kontrastu, widzenie barwne, rozwiązywanie zadań wzrokowo-przestrzennych, kontrolowanie ruchów gałek ocznych, stymulowanie odnowy fotoreceptorów. Najprawdopodobniej uczestniczy też w cyklicznym regulowaniu ciśnienia wewnątrzgałkowego. Ponadto wykazuje działanie neuroprotekcyjne. Dlatego choroba Parkinsona stanowi problem interdyscyplinarny, a w jej przebiegu mogą pojawić się zmiany okulistyczne. Najczęstsze z nich opisano w tabeli 1.
Większość pacjentów z PD skarży się na uczucie suchości, chropowatości, pieczenie lub nadmierne łzawienie oczu,5,7 będące wynikiem zaburzeń filmu łzowego. Pierwszym objawem zespołu suchego oka jest skrócony czas przerwania filmu łzowego (TBUT – tear film break-up time), który występuje nawet u ponad połowy pacjentów z nowo rozpoznaną PD.5 W późniejszych stadiach pojawiają się deficyt warstwy wodnistej (stwierdzany w teście Schirmera), dysfunkcja gruczołów Meiboma, a w barwieniu rogówki różem bengalskim – liczne filamenty rogówkowe i płytki śluzowe.7 Zaburzenia te nasila dodatkowo istotnie statystycznie rzadsze mruganie u osób z PD,5,7 będące najprawdopodobniej skutkiem uogólnionej hipokinezji. Wyniki badań wskazują, że przyczyną nieprawidłowości filmu łzowego u pacjentów z PD jest dysfunkcja układu autonomicznego, spowodowana obecnością ciał Lewy’ego w zwojach współczulnych, istocie czarnej śródmózgowia oraz obwodowych zwojach przywspółczulnych.8
U osób z PD zaobserwowano istotnie statystycznie częstsze występowanie charakterystycznych dla jaskry ubytków pola widzenia.9,10 Ponadto Bayer i wsp.9 obserwowali u nich częściej neuropatię nerwu II, przy czym ciśnienie wewnątrzgałkowe było niższe niż w grupie kontrolnej. Jaskrę otwartego kąta rozpoznano u 23,7% pacjentów z PD w porównaniu z 6,5% osób z grupy kontrolnej. Przyczyną jaskry normalnego ciśnienia jest obniżenie ciśnienia perfuzji ocznej, stanowiącego różnicę pomiędzy ciśnieniem tętniczym a ciśnieniem wewnątrzgałkowym. U pacjentów z PD ciśnienie tętnicze jest zwykle niższe niż u osób zdrowych,1 zatem również ciśnienie perfuzji jest u nich niższe. Badania z zastosowaniem optycznej koherentnej tomografii (OCT – optical coherence tomography) wykazały obniżoną grubość włókien nerwowych w okolicy tarczy nerwu II (RNFL – retinal nerve fiber layer). Może to być efekt ubytku komórek zwojowych, które bez działania neuroprotekcyjnego dopaminy wykazują zwiększoną podatność na apoptozę.9,11 Pojawiają się jednak badania, które nie wykazują różnic RNFL u pacjentów z PD w porównaniu z grupą kontrolną.12
U osób z PD mogą pojawić się również zaburzenia ruchów sakkadowych gałek ocznych i wodzenia za przedmiotem,13 zaburzenia widzenia barwnego oraz obniżenie czułości kontrastowej.14,15 Ponieważ dopamina bierze udział w modulacji sygnału wzrokowego, u pacjentów z PD może dochodzić do zaburzeń funkcji bioelektrycznej siatkówki i nerwu wzrokowego bez towarzyszących zmian stwierdzanych w badaniu okulistycznym. W badaniu elektrookulograficznym (EOG) u nieleczonych pacjentów w początkowym stadium PD zaobserwowano wydłużenie latencji maksymalnej amplitudy w adaptacji dziennej (tzw. light peak). Wraz z progresją choroby stwierdzono również obniżenie tej amplitudy.16 EOG odzwierciedla funkcję nabłonka barwnikowego siatkówki i fotoreceptorów, autorzy zasugerowali więc, że ta część siatkówki może być najbardziej podatna na obniżone stężenie dopaminy, ponieważ znajduje się najdalej w stosunku do wewnętrznej warstwy splotowatej, zawierającej komórki amakrynowe A18.
W elektroretinogramie stymulowanym wzorcem (PERG – pattern electroretinogram) u pacjentów z PD można zaobserwować wydłużenie latencji fali P50, która odzwierciedla funkcję nie tylko komórek zwojowych, ale również receptorów czopkowych plamki.17,18 Zmiany w badaniu PERG nasilają się przy zastosowaniu wzorca o niższym kontraście i wraz z progresją PD.
Wzrokowe potencjały wywołane stymulowane wzorcem (PVEP – pattern visual evoked potentials) dostarczają informacji o całej drodze wzrokowej, poczynając od siatkówki aż do kory wzrokowej. U nieleczonych pacjentów we wczesnych stadiach PD można stwierdzić wydłużenie latencji fali P100.17 W bardziej zaawansowanych stadiach dochodzi również do obniżenia amplitudy fali P100.19
Problem współwystępowania chorób narządu wzroku u pacjentów z PD jest mało znany. Wyniki badań wskazują na istotnie statystycznie częstsze występowanie u tych chorych jaskry i zespołu suchego oka. Nie ma natomiast danych na temat dwóch najczęstszych (według Światowej Organizacji Zdrowia) przyczyn ślepoty w populacji ogólnej – zaćmy i zwyrodnienia plamki związanego z wiekiem (AMD – age-related macular degeneration).
Dobre funkcjonowanie narządu wzroku ma istotne znaczenie w redukcji kosztów leczenia i opieki, a wzrok odgrywa ważną rolę w rehabilitacji pacjentów z PD. Ćwiczenia fizyczne z wykorzystaniem wzorca wzrokowego usprawniają nie tylko układ mięśniowo-szkieletowy, ale prowadzą także do powstania trwałych sprzężeń zwrotnych w ośrodkowym układzie nerwowym, omijających uszkodzone zwoje podstawy mózgu. Dzięki temu poprawa funkcji motorycznych po zakończeniu rehabilitacji utrzymuje się dłużej.
Świadomość, które choroby okulistyczne występują najczęściej u pacjentów z chorobą Parkinsona, ułatwia ich wczesną diagnostykę i leczenie. Może to polepszyć rokowanie i przyczynić się do spowolnienia progresji schorzenia neurodegeneracyjnego, wydłużenia czasu aktywnego życia społecznego oraz zmniejszenia kosztów dla budżetu państwa i społeczeństwa.