Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Pulmonologia
Standardy leczenia POChP
dr n. med. Agata Dutkowska
prof. dr hab. n. med. Adam Antczak
Przewlekła obturacyjna choroba płuc (POChP, COPD – chronic obstructive pulmonary disease) jest czwartą przyczyną zgonów na świecie. To choroba nieuleczalna, której można zapobiec. Dostępne leczenie, w tym zaprzestanie palenia tytoniu, pozwala na spowolnienie jej postępu. Umożliwia także zapobieganie powikłaniom.
Wprowadzenie
Celem leczenia POChP jest złagodzenie jej objawów, poprawa tolerancji wysiłku i jakości życia oraz zmniejszenie ryzyka progresji poprzez redukcję liczby zaostrzeń. Poza rzuceniem palenia nie ma przekonujących dowodów na to, by obecnie stosowana terapia istotnie ograniczała umieralność na POChP.
Kluczowe dla sukcesu leczenia jest zrozumienie podłoża choroby oraz udziału dymu tytoniowego w jej powstawaniu. Wszyscy chorzy powinni być zachęcani do rzucenia palenia i wspierani w zwalczaniu nałogu.
Patomechanizm POChP
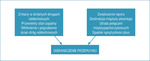
Przewlekle wdychany dym papierosowy i inne szkodliwe cząsteczki gazu, takie jak dym spalinowy, mogą powodować zapalenie dróg oddechowych. Przewlekła reakcja zapalna może prowadzić do destrukcji miąższu płucnego (rozedma) i przebudowy drobnych dróg oddechowych. Zmiany te prowadzą do postępującego ograniczenia przepływu powietrza i pułapki powietrznej, co objawia się dusznością. Do oceny zaburzeń przepływu powietrza w chorobach obturacyjnych służy spirometria – badanie niezbędne do pewnego rozpoznania POChP. Mechanizmy prowadzące do ograniczenia przepływu powietrza w POChP przedstawia rycina 1.
Leczenie farmakologiczne
Właściwa terapia farmakologiczna zmniejsza objawy POChP, redukuje częstość i stopień ciężkości zaostrzeń oraz poprawia ogólny stan zdrowia i tolerancję wysiłku chorego. Mimo pojawiania się nowych leków, coraz doskonalszych aparatów do ich wziewnego podawania czy też możliwości wygodnej terapii kombinowanej, do dzisiaj nie wynaleziono sposobu na zahamowanie istotnego spadku funkcji płuc w ocenie długoterminowej.
W obowiązujących standardach GOLD 2016 podkreślono konieczność indywidualizacji terapii z użyciem algorytmów oceny pacjenta w kierunku nasilenia objawów, częstości zaostrzeń, dostępności i możliwości przyjmowania konkretnego leku.
Na początku leczenia wziewnego należy pokazać choremu prawidłową technikę inhalowania leku oraz ocenić, czy potrafi on we właściwy sposób korzystać z inhalatora. Wybór odpowiedniego inhalatora, poza kosztem leku, powinien być podyktowany umiejętnością jego właściwej obsługi. Starsi pacjenci mający problemy z koordynacją mogą mieć trudności z korzystaniem z inhalatorów typu MDI (metered-dose inhaler), podczas używania którego należy zsynchronizować moment wdechu z uwolnieniem dawki leku. Alternatywą są inhalatory typu DPI (dry powder inhalers) aktywowane wdechem, w których prawidłowe przyjęcie leku zależy od możliwości osiągnięcia przez chorego średniego lub dużego przepływu wdechowego.
Dla pacjentów ze szczególnie dużą pułapką powietrzną i niskim przepływem wdechowym pewnym rozwiązaniem jest stosowanie leków w nebulizacji.
Ocena pacjenta chorego na POChP
W celu oceny pacjenta należy pogłębić wywiad dotyczący nasilenia objawów za pomocą skal mMRC (tab. 1) lub CAT (tab. 2), stopnia obturacji przy użyciu badania spirometrycznego (tab. 3) oraz historii przebytych zaostrzeń. Poniżej przedstawiono sposób kategoryzacji chorych do grupy A, B, C lub D na podstawie stopnia składowych wywiadu oraz rycinę podsumowującą (ryc. 2).
Objawy:
a) małe nasilenie: (mMRC 0-1 lub CAT <10) → chory należy do kategorii A lub C
b) duże nasilenie: (mMRC ≥2 lub CAT ≥10) → chory należy do kategorii B lub D
Obturacja dróg oddechowych:
a) kategoria spirometryczna GOLD 1 lub 2 → chory należy do kategorii A lub B
b) kategoria spirometryczna GOLD 3 lub 4 → chory należy do kategorii C lub D
Przebyte zaostrzenia:
a) ≤1 zaostrzenie/rok, bez hospitalizacji z powodu zaostrzeń → chory należy do kategorii A lub B
b) ≥2 zaostrzenia/rok lub ≥1 hospitalizacja z powodu zaostrzenia → chory należy do kategorii C lub D
W ocenie ryzyka zaostrzeń należy przyjmować największe ryzyko określone na podstawie wyniku spirometrii lub historii przebytych zaostrzeń (np. jeżeli wynik spirometrii wskazuje na małe ryzyko, a chory przebył hospitalizację, kwalifikujemy go do grupy C lub D).

Rycina 2. Klasyfikacja zaawansowania POChP uwzględniająca spirometryczne kryteria nasilenia obturacji (tab. 3), nasilenie duszności według mMRC (tab. 1) lub innych objawów choroby według wyniku testu CAT (tab. 2) i liczbę zaostrzeń w ostatnich 12 miesiącach
Klasyfikacja ta służy jako podstawa wyboru metody leczenia. Nie jest wykładnikiem naturalnej progresji choroby, tzn. w miarę upływu czasu chory nie przechodzi do kolejnych grup (A→B→C→D). Najczęściej wskutek pogorszenia czynności płuc i/lub przebytych zaostrzeń trafia z grupy A lub B do C lub D.
Leki rozszerzające oskrzela
Leki wziewne rozszerzające oskrzela są podstawą zwalczania objawów POChP. Wybór pomiędzy poszczególnymi grupami leków (β2-mimetyk, cholinolityk, teofilina czy terapia kombinowana) zależy od indywidualnej odpowiedzi pacjenta i oceny potencjalnych efektów ubocznych. Bronchodilatatory stosowane są przewlekle w celu zapobiegania objawom lub doraźnie. Leki długo działające są wygodniejsze do stosowania oraz zapewniają długoterminowe złagodzenie objawów w porównaniu z lekami krótko działającymi. Terapia kombinowana poprawia współpracę z pacjentem i zmniejsza ryzyko rozwoju działań niepożądanych w porównaniu z korzystaniem z dwóch oddzielnych preparatów.
Typowe leki stosowane w terapii POChP opisano w tabeli 4.
Długo działające β2 mimetyki wziewne (LABA – long-acting beta2-agonists)
Działanie β2-agonistów polega na rozkurczaniu mięśni gładkich oskrzeli i zapobieganiu ich skurczowi poprzez pobudzanie receptorów adrenergicznych typu b2. Cholinolityki działają głównie na toniczne, stałe, napięcie mięśni gładkich, natomiast β2-agoniści usuwają doraźny, reaktywny skurcz mięśni gładkich lub mu zapobiegają. Jest to efekt blokowania cyklazy adenylowej powodujący zwiększenie wewnątrzkomórkowego stężenia cyklicznego AMP (adenosine monophosphate) w komórkach docelowych. Dodatkowym działaniem β2-agonistów jest poprawa transportu śluzowo-rzęskowego oraz zwiększenie dostępności białka wiążącego glikokortykosteroidy. Wpływ LABA na najważniejsze efekty terapeutyczne leczenia POChP przedstawiono w tabeli 5.
Działania niepożądane β-2 mimetyków:
- tachykardia zatokowa, zaburzenia rytmu serca
- drżenie mięśniowe
- hipokaliemia, zwiększenie zużycia tlenu.
Leki antycholinergiczne
Bromek ipratropium, bromek tiotropium, bromek glikopyronium, umeklidynium są antagonistami receptorów muskarynowych M1, M2 i M3. Receptory zlokalizowane są na mięśniach gładkich oskrzeli i gruczołach podśluzówkowych, a ich stymulacja prowadzi do skurczu mięśni gładkich i wydzielania śluzu. Najistotniejsze z punktu widzenia wentylacji jest zablokowanie receptorów M3, które znosi toniczne, spoczynkowe napięcie cholinergiczne. Powoduje to rozszerzenie oskrzeli wskutek pociągania ich ścian na zewnątrz przez włókna sprężyste miąższu płuc. Drugi mechanizm rozszerzenia oskrzeli może wynikać z hamowania wydzielania mediatorów zapalenia przez zakończenia podśluzówkowych nerwów czuciowych i w ten sposób zmniejszać skurcz oskrzeli oraz produkcję śluzu. Wpływ tiotropium na najważniejsze wyniki leczenia POChP przedstawiono w tabeli 6.
Cholinolityki są słabo wchłaniane. Ogranicza to ich efekty uboczne i czyni terapię bardzo bezpieczną. Do działań niepożądanych leków cholinolitycznych należą:
- suchość w jamie ustnej
- metaliczny smak w ustach
- ostry atak jaskry przy stosowaniu w nebulizacji.
Metyloksantyny
Terapia teofiliną jest kontrowersyjna. Lek ten jest nieselektywnym inhibitorem fosfodiesterazy oraz wykazuje wiele działań pozaoskrzelowych. Jego stosowanie przynosi mniej korzyści, a jego tolerancja jest gorsza w porównaniu z innymi wziewnymi bronchodilatatorami. Teofilinę należy rozważyć dopiero wtedy, gdy powyższe leki są niedostępne lub nietolerowane. Teofilina jest metabolizowana przez cytochrom P450, wchodzi więc w liczne interakcje z innymi substancjami podobnie metabolizowanymi. Zdolność do jej eliminacji z organizmu maleje z wiekiem. Jej wpływ na najważniejsze wyniki leczenia POChP przedstawiono w tabeli 7.
Toksyczność teofiliny zależy od dawki, a jej indeks terapeutyczny jest niski. Trudności w leczeniu wynikają z ujawniania się dobroczynnego wpływu terapii dopiero przy dawce bliskiej toksycznej.
Mimo wielu zastrzeżeń teofilina może być stosowana jako lek alternatywny zalecany do długotrwałego leczenia chorych na POChP w każdej kategorii zaawansowania. Preferowane są tabletki o powolnym uwalnianiu leku. Dobowa dawka podtrzymująca dla dorosłych wynosi 8-12 mg/kg m.c./24 h (przeciętnie 300 mg co 12 h). W przypadku braku możliwości monitorowania stężenia leku we krwi (zakres stężeń terapeutycznych: 8-20 μg/ml) nie należy przekraczać dawki dobowej 900 mg.
Do działań niepożądanych teofiliny należą:
- nadkomorowe i komorowe zaburzenia rytmu serca
- napady padaczkowe grand mal
- bóle głowy, bezsenność
- nudności, GERD.
Glikokortykosteroidy wziewne
Glikokortykosteroidy wziewne (wGKS) w POChP, w przeciwieństwie do astmy, nie są podstawą leczenia. Leki te mogą zwiększać ryzyko zapalenia płuc i dlatego należy starannie rozważyć długotrwałą terapię. Wytyczne zalecają ich stosowanie u pacjentów z utrwaloną obturacją i FEV1 <60% oraz fenotypem zaostrzeniowym niezależnie od FEV1 zawsze w połączeniu z długo działającym bronchodilatatorem.
Leki te zmniejszają objawy choroby, poprawiają funkcję płuc i jakość życia oraz zmniejszają częstość zaostrzeń, nie modyfikują jednak długoterminowego spadku FEV1 ani śmiertelności u pacjentów z POChP.
Do działań niepożądanych wziewnych GKS należą:
- kandydoza jamy ustnej
- chrypka
- sine wybroczyny na skórze.
Kombinacje leków w POChP
Łączenie leków o różnych mechanizmach działania skutkuje większym efektem rozszerzającym oskrzela, zmniejszeniem ryzyka działań niepożądanych oraz lepszą współpracą z pacjentem. Łączyć można wszystkie wymienione leki.
Kombinacje leków rozszerzających oskrzela
Leczenie bronchodilatatorami z różnych grup poprawia FEV1. Najczęstsze połączenia leków rozszerzających to stosowanie w jednym inhalatorze krótko działającego β-2 mimetyku (SABA – short acting beta-2 agonist) z krótko działającym cholinolitykiem. Coraz nowsze i dłużej działające leki z tej grupy są również dostępne w postaci jednego inhalatora do stosowania raz na 24 h. Niedogodnością jest jednak ich wciąż wysoka cena. Udowodniono, że taka terapia oprócz poprawy funkcji płuc może być skuteczniejsza w zapobieganiu zaostrzeniom. W ciężkiej i bardzo ciężkiej postaci POChP (kategoria C i D), w przypadkach uciążliwej duszności, można stosować wszystkie trzy klasy leków rozszerzających oskrzela razem.
Kombinacja wziewny GKS/LABA
W kontrolowanych badaniach klinicznych skojarzone leczenie wziewnymi GKS i długo działającymi lekami rozszerzającymi oskrzela okazało się bardziej skuteczne w porównaniu z placebo i każdym z tych leków stosowanym w monoterapii. Takie połączenie zaleca się pacjentom ze średnim do bardzo ciężkiego POChP. Dodatkowe włączenie tiotropium poprawia funkcję płuc, jakość życia i zmniejsza częstość zaostrzeń. Należy jednak pamiętać, że terapia skojarzona wziewnymi GKS zwiększa ryzyko zapalenia płuc i nie redukuje umieralności z powodu POChP.
Systemowe GKS
Glikokortykosteroidów systemowych nie zaleca się w monoterapii długoterminowej POChP. Szczególnie ważne u chorych na POChP są działania niepożądanie glikokortykosteroidoterapii doustnej. Jedną z najpoważniejszych jest miopatia posterydowa, która u pacjentów z bardzo ciężką postacią choroby pogłębia dodatkowo ogólną niepełnosprawność i przyczynia się do niewydolności oddechowej w mechanizmie wyczerpania mięśni oddechowych.
Jedyne wskazanie do ich stosowania obejmuje zaostrzenie POChP, kiedy to korzyści przewyższają skutki uboczne. W czasie zaostrzenia systemowe GKS zmniejszają objawy, poprawiają funkcję płuc, zwiększają powodzenie terapii, skracają okres hospitalizacji oraz zmniejszają ryzyko ponownego ciężkiego zaostrzenia w ciągu 30 dni.
Inhibitory fosfodiesterazy-4 (PDE-4) w POChP
Zasada działania roflumilastu – przedstawiciela inhibitorów fosfodiesterazy-4 – polega na zmniejszeniu stanu zapalnego poprzez hamowanie PDE-4. Prowadzi to do zwiększenia stężenia wewnątrzkomórkowego cAMP oraz zmniejszenia związanego z POChP nieprawidłowego działania leukocytów, komórek mięśni gładkich naczyń krwionośnych dróg oddechowych i płuc, komórek śródbłonka i nabłonka dróg oddechowych oraz fibroblastów.
Lek ten nie ma bezpośredniego działania bronchodilatacyjnego, udowodniono jednak, że w połączeniu z salmeterolem lub tiotropium poprawia FEV1. Powinien być stosowany zawsze w połączeniu z przynajmniej jednym długo działającym lekiem rozszerzającym oskrzela. Ponadto roflumilast zmniejsza częstość cięższych zaostrzeń.
Do działań niepożądanych roflumilastu ustępujących wraz z kontynuacją leczenia, należą:
- nudności, utrata apetytu
- bóle brzucha, biegunka
- zaburzenia snu
- bóle głowy.
Podczas terapii roflumilastem należy monitorować masę ciała i unikać włączania tego leku u pacjentów z niedowagą. Nie należy stosować roflumilastu przy jednoczesnym stosowaniu teofiliny.
Schemat leczenia
Podsumowanie strategii leczenia POChP przedstawiono w tabeli 8.
Szczepienia w POChP
Szczepienia przeciwko grypie oraz pneumokokom powinny być zalecane każdemu choremu na POChP, zwłaszcza osobom starszym, z cięższą postacią choroby oraz przy współistnieniu chorób układu krążenia.
Coroczne szczepienia przeciwko grypie zapobiegają rozwojowi ciężkiego zapalenia dolnych dróg oddechowych, wymagającego hospitalizacji i zmniejszają ryzyko śmierci z powodu POChP.
Szczepienie przeciwko pneumokokom zalecane jest jednorazowo u chorych na POChP >65 r.ż. oraz młodszych z poważnymi chorobami towarzyszącymi, np. z chorobą serca.
Inne leki w POChP
α-1 antytrypsyna
U młodych pacjentów z rozedmą należy przeprowadzić diagnostykę w kierunku dziedzicznego niedoboru α-1-antytrypsyny. Terapia α-1-antytrypsyną nie jest zalecana w POChP niezwiązanej z jej niedoborem.
Przewlekła antybiotykoterapia
Codzienna, profilaktyczna antybiotykoterapia w POChP nie jest zalecana. Stosowanie tych leków ogranicza się jedynie do leczenia zaostrzeń. Antybiotykami I rzutu są amoksycylina z kwasem klawulanowym lub bez niego. Antybiotykami drugiego wyboru lub w przypadku niepowodzenia leczenia wstępnego są cefalosporyny drugiej generacji, makrolidy nowej generacji (klarytromycyna, azytromycyna) lub fluorochinolony „oddechowe” (moksyfloksacyna, lewofloksacyna).
Mukolityki
Stosowanie leków mukolitycznych w POChP (ambroksol, N-acetylocysteina) jest uzasadnione jedynie czasowo, gdy występuje kaszel z lepką, gęstą plwociną. Istnieją pojedyncze doniesienia zmniejszenia liczby zaostrzeń u pacjentów w stadium GOLD 2 stosujących wysokie dawki N-acetylocysteiny.
Leki przeciwkaszlowe
Kaszel jest ważnym mechanizmem obronnym, nie tylko w POChP. Codzienne stosowanie leków przeciwkaszlowych w stabilnej POChP jest niezalecane.
Morfina
Podawanie morfiny w paliatywnym leczeniu schyłkowej duszności w bardzo ciężkiej POChP jest uzasadnione.
Rehabilitacja oddechowa
Rehabilitacja oddechowa przynosi wiele dobroczynnych efektów. Najważniejsze z nich to zmniejszenie objawów choroby, poprawa jakości życia oraz zwiększenie wydolności wysiłkowej. Powinna być zalecana każdemu choremu na POChP z dusznością wysiłkową. Minimalny czas rehabilitacji oddechowej to 6 tygodni. Nawet jednorazowy udział w programie rehabilitacji oddechowej jest skuteczny. Przy braku możliwości skierowania chorego na program refundowany przez NFZ powinno zalecać się aktywność fizyczną w postaci np. codziennego spaceru 20 min dziennie.
Leczenie uzależnienia od nikotyny
Nikotynowa terapia zastępcza w każdej postaci (gumy z nikotyną do żucia, plastry z nikotyną, tabletki podjęzykowe) skutecznie wydłuża okres abstynencji. Przeciwwskazania do tego typu terapii obejmują niestabilną chorobę wieńcową, istotne zaburzenia rytmu serca, nieleczoną chorobę wrzodową żołądka, niedawno przebyty zawał mięśnia sercowego lub udar. Kwaśne napoje (kawa, soki owocowe) zwiększają wchłanianie nikotyny z przewodu pokarmowego.
Leki pierwszego wyboru w uzależnieniu od tytoniu obejmują wareniklinę, bupropion i cytyzynę (tab. 9).
Tlenoterapia
Długotrwałe podawanie tlenu (>15 h/24 h) jest wskazane u chorych z przewlekłą niewydolnością oddechową objawiającą się zaburzeniami gazometrycznymi zmierzonymi 2 razy w ciągu 3 tygodni w spoczynku w stabilnym okresie choroby. Pacjenci muszą spełniać następujące kryteria gazometryczne:
- pO2 ≤55 mmHg (odpowiada to saturacji ≤88%)
- pO2 55-60 mmHg (odpowiada to saturacji ≤88%) oraz nadciśnienie płucne, obrzęki obwodowe sugerujące prawokomorową niewydolność serca lub policytemia (hematokryt >55%)