Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Polscy naukowcy rozpracowują enzym wirusa
Naukowcy z Politechniki Śląskiej w międzynarodowym zespole badającym SARS-CoV-2
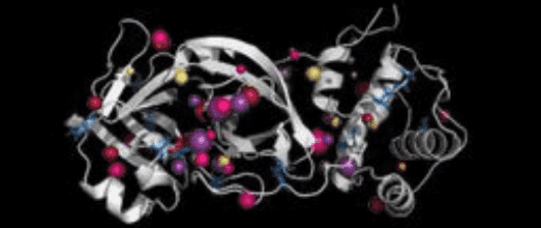
Nowoczesne metody obliczeniowe pozwalają na znaczne przyspieszenie badań pozwalających poznać strukturę i funkcję białek – również wirusowych, a w efekcie służą jako pomoc w zaprojektowaniu skutecznych leków czy szczepionek. Naukowcy z grupy badawczej Tunneling Group, działającej przy Centrum Biotechnologii Politechniki Śląskiej, wykorzystując symulacje dynamiki molekularnej i autorskie oprogramowanie, dogłębnie poznali strukturę głównej proteazy wirusa SARS-CoV-2, jednego z kluczowych enzymów w cyklu życiowym wirusa.
Młody zespół działający pod kierunkiem dr. hab. Artura Góry z Centrum Biotechnologii Politechniki Śląskiej w ramach nawiązanej współpracy z badaczami z Uniwersytetu Alberty w Kanadzie oraz Politechniki w Turynie scharakteryzował główną proteazę SARS-CoV-2 (SARS-CoV-2 Mpro) oraz porównał ją z odpowiadającym enzymem wirusa wywołującego SARS (SARS-CoV Mpro).
– Początkowo chcieliśmy porównać zachowanie obu enzymów i na tej podstawie zaproponować związki, które były już wcześniej przebadane i mogłyby szybko zostać wprowadzone, aby zahamować aktywność głównej proteazy, a tym samym zahamować namnażanie się wirusa. Niestety, już podczas wstępnych analiz okazało się, że kieszeń wiążąca substrat, w której miałoby następować wiązanie związków hamujących działanie enzymu, jest bardzo ruchliwa. Co oznacza, że nie możemy skorzystać z drogi na skróty – opowiada o wynikach badań dr hab. Artur Góra.
Naukowcy dodatkowo zaobserwowali, że cel molekularny może łatwo ulec dalszym zmianom, gdyż charakteryzuje się dużą zmiennością ewolucyjną. To w efekcie oznaczałoby, że cały wysiłek może pójść na marne. Dlatego niezwłocznie rozpoczęli prace nad wytypowaniem innego – mniej ruchliwego i ewolucyjnie stabilnego – rejonu białka Mpro, do którego potencjalne leki mogłyby się wiązać skuteczniej.
– Poprzez połączenie analizy dynamiki białka z analizą ewolucyjną oraz analizą wpływu dalszych mutacji na stabilność enzymu chcemy wygrać ten szczególnego rodzaju wyścig zbrojeń, inaczej mówiąc chcemy przechytrzyć wirusa i przewidzieć kolejne możliwe drogi jego ewolucji. Już teraz wiemy, że wirus wyizolowany we Włoszech różni się od tego z Wuhanu. Mutacje prowadzące do zmian w sekwencji głównej protazy to także tylko kwestia czasu i chcemy być na tę ewentualność dobrze przygotowani – dodaje dr hab. Artur Góra
Prace nie mają charakteru wyłącznie teoretycznego, skuteczność wiązania się wytypowanych związków można błyskawicznie sprawdzić dzięki nowoczesnej platformie do wysokoprzepustowej analizy interakcji międzycząsteczkowych dostarczonej przez firmę NanoTemper.
– Możemy mówić o dużym szczęściu w tej sytuacji, grant na pozyskanie unikalnej infrastruktury badawczej otrzymaliśmy pod koniec zeszłego roku i przy wykorzystaniu MonolithNT.Automated jesteśmy w stanie zweryfikować kilkaset związków dziennie – podsumowuje dr hab. Artur Góra.
Prace w kierunku scharakteryzowania SARS-CoV-2 Mpro ruszyły w momencie, kiedy została udostępniona struktura krystalograficzna tego białka. Na jej podstawie wykonano symulacje dynamiki molekularnej, które następnie przeanalizowano pod kątem zmian dynamiki i zachowania białka. Grupa Tunneling Group stworzyła program AQUA-DUCT, który pozwala na przeanalizowanie dynamiki zachowania białka z uwzględnieniem zmian w dostępnych przestrzeniach wewnątrzcząsteczkowych, co przy konwencjonalnej analizie jest zwykle pomijane. Dodatkowo, badania zostały rozszerzone o analizę ewolucyjną wirusowych białek Mpro oraz badanie stabilności białka. Pierwsze wyniki badań zespołu dr. Góry zostały udostępnione dla wszystkich zainteresowanych już na początku marca, czekają również na recenzje w jednym z topowych czasopism.
