Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Aktualne poglądy
Znaczenie miejscowych glikokortykosteroidów w terapii atopowego zapalenia skóry
Dr n. med. Andrzej Jaworek
Prof. dr hab. med. Anna Wojas-Pelc
Atopowe zapalenie skóry (AZS; atopic dermatitis, AD) to zapalna, świądowa, przewlekła (przewlekła-nawracająca) choroba skóry, szczególnie częsta w rodzinach, w których występują inne schorzenia z kręgu atopii (astma oskrzelowa, alergiczne zapalenie nosa i spojówek, alergia pokarmowa). AZS jest jedną z najczęstszych, wg niektórych źródeł najczęstszą, niezakaźną chorobą zapalną skóry, która dotyka 20 proc. dzieci i 2-8 proc. dorosłych.[1,2] Według szacunkowych danych Polskiego Towarzystwa Alergologicznego na AZS choruje 1,5-2,5 mln Polaków.[3] Warte podkreślenia jest, że mimo obiegowych opinii wiążących występowanie AZS tylko z okresem dziecięcym wciąż rośnie zachorowalność na to schorzenie wśród ludzi dorosłych. W badaniu Barbarot i wsp.[4] obejmującym populacje dorosłych ze Stanów Zjednoczonych, Kanady, Japonii i Europy oszacowano występowanie tej choroby na 4,9 proc. ankietowanych.
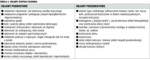
W związku z szerokim rozpowszechnieniem AZS liczne towarzystwa naukowe skupiające głównie dermatologów i alergologów przygotowały rekomendacje terapeutyczne dotyczące diagnostyki i terapii tej choroby. W większości z nich miejscowe glikokortykosteroidy (mGKS) są uznane za leki pierwszego wyboru w miejscowej terapii immunosupresyjnej AZS.[5-7] W 2018 roku opublikowane pod auspicjami Europejskiej Akademii Dermatologii i Wenerologii oraz Europejskiej Akademii Alergologii i Immunologii Klinicznej wytyczne eksperckie podkreślają szczególne znaczenie mGKS w leczeniu AZS, umiejscawiając te leki na odpowiednich piętrach schematu terapeutycznego w grupie pacjentów dziecięcych i dorosłych.[5] (ryc. 1).

Ryc. 1. Terapia AZS w zależności od nasilenia objawów – na podstawie wytycznych z 2018 roku. EDF/ETFAD/EADV/EAACI/EFA/ESDaP/ESPD/GA2LEN/UEMS.
W 1952 roku ukazał się artykuł dotyczący zastosowania octanu hydrokortyzonu (nazwanego substancją F) w terapii miejscowej chorób skóry. Marion Baldur Sulzberger (słynny „Mr Dermatology”) (1895-1983) oraz Victor H. Witten (1916-2007) w obrębie 34 linijek tekstu, jednej tabeli oraz jednej pozycji piśmiennictwa zamieścili informacje, które na zawsze zmieniły dermatologię. Autorzy przedstawili efekt terapii badaną substancją u 19 chorych w wieku 2-56 lat (8 chorowało na atopowe zapalenie skóry). Pozytywny efekt kliniczny zaobserwowany u większości pacjentów przekonał specjalistów chorób skóry na całym świecie do powszechnego stosowania mGKS, czego najlepszym odzwierciedleniem jest dokonany przez Howarda Maibacha humorystyczny podział dermatofarmakologii na okresy BC (before corticosteroids) oraz AC (after corticosteroids).[8]
Niestety już trzy lata po publikacji Sulzbergera i Wittena ukazało się pierwsze z serii doniesienie o działaniach niepożądanych mGKS. W 1955 roku jeden z najsłynniejszych dermatologów amerykańskich Thomas B. Fitzpatrick (1919-2003) i wsp. przedstawili opis systemowego działania niepożądanego (obrzęki związane z retencją sodu) octanu fludrokortyzonu (pierwszy fluorowany mGKS wprowadzony do terapii w 1953 roku) stosowanego miejscowo.[9] Pierwszy opis działania niepożądanego mGKS w obrębie skóry zawdzięczamy Epsteinowi i wsp., którzy już w 1963 roku (tj. 11 lat po wprowadzeniu mGKS do terapii dermatologicznej) na łamach „Archives of Dermatology” zaprezentowali opis pięciu chorych, u których stosowany miejscowo z powodu zmian wyprzeniowych pachwin krem zawierający połączenie acetonidu triamcynolonu (II generacja mGKS, fluorowany mGKS wprowadzony do terapii w 1960 roku), granicydyny oraz nystatyny spowodował powstanie atroficznych rozstępów.[10] Stosowanie mGKS pierwszych generacji było obarczone ryzykiem różnorodnych działań niepożądanych, których „teatralność” na wiele lat zdominowała sposób postrzegania tych leków zarówno przez pacjentów, jak i lekarzy (szczególnie niedermatologów).
Budowa wszystkich glikokortykosteroidów jest oparta na strukturze cholesterolu, tj. szkielet cząsteczki tworzy 17 atomów węgla, które formują cztery pierścienie (3 sześciowęglowe: A-C i 1 pięciowęglowy: D; pierścień pregnanu). Wprowadzane na przestrzeni lat liczne modyfikacje cząsteczki bazowej spowodowały, że każda kolejna generacja mGKS miała coraz mniejszy potencjał wywoływania działań niepożądanych, przy coraz większej efektywności (redukcja świądu skóry, bezsenności oraz zaostrzeń zmian u chorych na AZS). Zwłaszcza VI generacja mGKS (budesonid, furoinian mometazonu, prednikarbat, aceponian metyloprednizolonu, alklometazon, propionian flutikazonu) jest uważana za szczególnie bezpieczną.[8,11]
Wybrane objawy niepożądane (systemowe i miejscowe) związane ze stosowaniem mGKS wyszczególniono w tabelach 1 i 2. Pomimo ich powszechności (zwłaszcza w przypadku chorych leczonych przez lekarzy niedermatologów) większość z nich nie jest zgłaszana. Sytuacja ta dotyczy szczególnie tych mGKS, które zostały wprowadzone do lecznictwa wiele lat temu (tab. 3).
Charakterystyczne objawy zespołu Cushinga (ZC) zostały podsumowane w tabeli 4. Najczęstszą przyczyną egzogennego ZC są leki glikokortykosteroidowe (także stosowane miejscowo). W diagnostyce choroby przeprowadza się wiele badań diagnostycznych, wśród których szczególne znaczenie ma zwiększenie stężenia wolnego kortyzolu w surowicy i ślinie, zaburzenie rytmu dobowego wydzielania kortyzolu, zwiększone wydzielanie wolnego kortyzolu, a szczególnie test hamowania deksametazonem.[12]
W badaniach grup Scoggins oraz Ortegi potwierdzono, że dawka propionianu klobetazolu (jednego z najsilniejszych mGKS) wystarczająca do wywołania supresji kory nadnerczy oscyluje w granicach 14 g/tydzień, natomiast dla dipropionianu betametazonu wynosi ona 50 g/tydz.[13,14]
Wśród miejscowych działań niepożądanych mGKS szczególne miejsce zajmuje posterydowa atrofia skóry (GC, induced skin atrophy), do pojawienia się której może dochodzić już po 7 dniach stosowania miejscowego bardzo silnego mGKS pod okluzją (lub po 14 dniach bez okluzji).[15] Na pojawienie się posteroidowej atrofii skóry mają wpływ:
- okolica, na którą preparat mGKS jest stosowany,
- częstotliwość aplikacji leku,
- czas trwania terapii,
- siła mGKS, wiek pacjenta.