Wymaz pobrany z szyjki macicy przynosi o 40% mniej dodatnich wyników niż pojedynczy wymaz z pochwy.14 Badania wykazały, że pobieranie wymazu z okolic pochwy i odbytu łącznie znacznie zwiększa odsetek wykrywania kolonizacji paciorkowcami grupy B.15,16 Wymazy okołoodbytnicze mogą być równoważne z wymazami pobieranymi z odbytu,17,18 ale nie zostały formalnie zatwierdzone, gdyż nie są jednak optymalne.13 Kolejne wydania biuletynów CDC i ACOG miały na celu wyjaśnienie metod pobierania wymazu w celu standardyzacji praktyk i minimalizacji prawdopodobieństwa niewłaściwego pobrania oraz uzyskania wyników fałszywie ujemnych.
Samodzielne pobieranie wymazu w kierunku paciorkowców grupy B, po przekazaniu odpowiednich wskazówek, uznaje się za akceptowalną alternatywę. Randomizowane badanie ze skrzyżowaniem grup 330 kobiet przeprowadzone w Kanadzie wykazało, że czułość w przypadku samodzielnego pobierania wymazu – 87,5% (95% PU 77,0-93,8) – była stosunkowo wysoka w porównaniu do czułości w przypadku materiału pobieranego przez lekarza wynoszącej 96,9% (95% PU 88,7-99,8).19 Badanie z udziałem 251 ciężarnych wykazało, że czułość u kobiet, które samodzielnie pobierały wymaz w kierunku paciorkowców grupy B, wynosiła 98,4%.20
Badania laboratoryjne: od hodowli do szybkich testów
Badanie laboratoryjne z zastosowaniem pożywek hodowlanych, które zazwyczaj wymaga od 36 do 72 godzin czasu inkubacji, pozostaje złotym standardem. Najnowsze wytyczne CDC zalecają szybkie testy, w przypadku których uzyskanie wyników zajmuje <30 minut, a dokładność wynosi >90%.11
Technicznym ograniczeniem oryginalnej pożywki agaru z krwią był przerost innych bakterii, co ograniczało wykrywanie paciorkowców grupy B.21 Modyfikacje polegały m.in. na dodawaniu czynników mających na celu wyeliminowanie innych bakterii oraz wzbogaconego bulionu, którego zadaniem było wspomaganie wzrostu paciorkowców grupy B.22 Zgodnie z obowiązującym obecnie złotym standardem po inokulacji stosuje się wzbogacony bulion (tj. bulion Lim, bulion TransVag lub bulion Carrot) i inkubuje przez 18-24 h, a następnie dodaje substancje selekcyjne na 18-24 h. W przypadku stwierdzenia kolonii poddaje się je ekstrakcji w celu określenia typu paciorkowca – grupy A lub B. Jeśli to konieczne, określa się następnie wrażliwość na antybiotyki (kolejne 12-24 h).
Konieczność przedłużonej inkubacji nie pozwala na jej zastosowanie w trakcie porodu. Z tego powodu przez ostatnie 30 lat badano różne szybkie testy. Po raz pierwszy analizowano je przy użyciu metod aglutynacji lateksowej w latach 80. XX wieku, ale miały one słabą czułość w przypadku małej kolonizacji.23 Testy immunooptyczne, immunoenzymatyczne i hybrydyzacja DNA polegały na wiązaniu unikalnych antygenów paciorkowców grupy B lub fragmentów RNA. Mimo istotnego skrócenia czasu badania metody te nie są optymalne z uwagi na duże różnice w czułości i swoistości.24
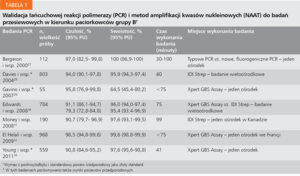
Tabela 1. Walidacja łańcuchowej reakcji polimerazy (PCR) i metod amplifikacji kwasów nukleinowych (NAAT) do badań przesiewowych w kierunku paciorkowców grupy B†
W ciągu ostatnich 15 lat intensywnie badano zastosowanie łańcuchowej reakcji polimerazy (polymerase chain reaction, PCR) lub metod amplifikacji kwasów nukleinowych (nucleic acid amplification tests, NAAT), aby poprawić szybkość i dokładność badań w kierunku paciorkowców grupy B w okresie przed- i okołoporodowym.25,26 W dwóch głównych testach – Xpert GBS Assay i IDI-Strep – stosuje się primery DNA unikalne dla paciorkowców grupy B. Nie wymagają one inkubacji w bulionie. Ostatnie wersje testów systematycznie osiągają czułość >90% (tab. 1).27-33
Testy PCR nie zostały wdrożone do powszechnego stosowania w szpitalach ani laboratoriach ambulatoryjnych, przede wszystkim ze względu na koszt i brak możliwości określenia antybiotykowrażliwości, jeśli wynik okaże się dodatni. Jednak w miarę postępu technologicznego i spadku kosztów spowodowanych częstszym stosowaniem wysoka czułość sprawia, że testy oparte na PCR stanowią lepszą alternatywę dla badania śród-, a niekiedy także przedporodowego . Modele analizy korzyści w stosunku do kosztów wykazały potencjalny zysk 6 dolarów na poród w przypadku śródporodowego zastosowania testów PCR w porówania do standardowego posiewu w 35-37 tygodniu ciąży.34
Szybkie śródporodowe testy przesiewowe na obecność paciorkowców grupy B są idealne w przypadku kobiet, które mają niedostateczną lub są pozbawione opieki przedporodowej oraz w przypadku pacjentek mających objawy porodu przedwczesnego lub przedwczesnego pęknięcia błon płodowych. Zastosowanie testów PCR, które pozwalają na uzyskanie wyników w ciągu 1-2 godzin u pacjentek z grupy dużego ryzyka, jest korzystniejsze niż terapia wynikająca z oceny ryzyka. W przypadkach, gdy istnieją obawy o to, że antybiotyk zostanie przyjęty z opóźnieniem, pacjentki mogą otrzymać jedną dawkę po badaniu śródporodowym. Wówczas, po uzyskaniu wyniku, terapia może zostać na jego podstawie zmodyfikowana, co tym samym zminimalizuje niepotrzebną ekspozycję noworodka na empiryczną antybiotykoterapię.
Opinia komitetu ACOG z 2011 roku zawiera algorytm dla kobiet z nieznanym wynikiem posiewu oraz pacjentek z objawami przedwczesnego porodu i PPROM. Choć opinia nie sugeruje zastosowania w takich sytuacjach szybkich testów przesiewowych, wydają się one logiczną alternatywą dla empirycznej profilaktyki antybiotykowej lub przedłużonej terapii w okresie neonatalnym. Ponadto ujemny wynik szybkiego testu ma konkretne implikacje dla pacjentek uczulonych na penicylinę, dla których alternatywnym antybiotykiem jest klindamycyna lub wankomycyna; leki te nie byłby konieczne w przypadku ujemnego wyniku szybkiego testu.
Ostatnio opublikowano pracę na podstawie analizy wyników posiewów wykonanych w 35-37 tygodniu ciąży i zestawienia ich z posiewami okołoporodowymi. W przeciwieństwie do czułości na poziomie 87% zgłaszanej przez Yanceya i wsp.8 czułość w tym badaniu wynosiła tylko 54,3-69,2% (tab. 2).
Jak nadmieniono wcześniej, dokonująca się w czasie zmiana w kolonizacji u matki może się także przyczyniać do niższej czułości standardowych posiewów wykonywanych przed porodem. Do wyników fałszywie ujemnych mogą się także przyczyniać nieoptymalne metody pobierania wymazu i mniejsza kolonizacja. W tym drugim przypadku czulsze metody amplifikacji DNA mogą być pomocne w potwierdzeniu rzeczywiście dodatniego wyniku.
Lepszą czułość w wykrywaniu paciorkowców grupy B można osiągnąć za pomocą modyfikacji dostępnych technik. W zmodyfikowanych testach najpierw stosuje się wzbogacony bulion i inkubację trwającą 18-24 h, a następnie amplifikację techniką PCR primera swoistego dla paciorkowców grupy B do Streptococcus agalactiae, co zajmuje około 1 godziny. Illumigene, przykład takiego zmodyfikowanego testu, bada wysoce konserwatywną sekwencję 213 par zasad Streptococcus agalactiae znajdującą się we wszystkich ośmiu szczepach paciorkowców grupy B. Test pozwala uzyskać czułość 98,6% (95% PU 96,5-99,5) i swoistość 93,2% (95% PU 91,6-94,5). Został opracowany w celu poprawy dokładności przesiewowych badań przedporodowych i nie jest przeznaczony do stosowania śródporodowego.
O wyższej czułości w porównaniu do standardowego posiewu świadczy fakt, że 64 próbki dające wynik negatywny w posiewie okazały się dodatnie zarówno w przypadku zastosowania Illumigene, jak i niezależnej metody molekularnej. BD GeneOhm to inny łączony test PCR o nieco szerszym zakresie czułości, w zależności od zastosowanej pożywki (92,5-100%).26 Dalsze badania zweryfikują potencjalną przewagę tych metod i potwierdzą, miejmy nadzieję, wyższą czułość w wykrywaniu kolonizacji paciorkowcami grupy B w okresie przedporodowym.
Aby ponownie ocenić optymalny czas przeprowadzania badań przesiewowych, konieczne są dodatkowe badania, ponieważ test przeprowadzony bliżej terminu porodu może zwiększać odsetek wyników fałszywie ujemnych. Starania na rzecz zmniejszenia do minimum wyników fałszywie ujemnych są kluczowe dla identyfikacji kobiet, które powinny otrzymać śródporodową profilaktykę antybiotykową mającą na celu zapobieżenie posocznicy u noworodków.
Contemporary OB/GYN, Vol. 58, No. 7, July 2013, p. 40. GBS screening. An update on guidelines and methods.
