Strategie antybiotykoterapii
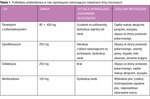
Profilaktyka antybiotykowa jest bardzo skutecznym sposobem zmniejszania częstości występowania nawrotów ZUM. Do najczęściej stosowanych leków należą połączenie trimetoprimu z sulfametoksazolem lub sam trimetoprim, cyprofloksacyna, cefaleksyna oraz nitrofurantoina (tab. 1). Standardowe schematy dawkowania polegają na podawaniu małej dawki wieczorem w celu uzyskania efektywnego stężenia leku w moczu bez wywoływania oporności wśród bakterii flory jelitowej. Ma to zasadnicze znaczenie, ponieważ jelito jest źródłem potencjalnych uropatogenów i większe dawki wpłyną niekorzystnie na skuteczność profilaktyki.
Zalecane dawki to 80 mg trimetoprimu i 400 mg sulfametoksazolu, 250 mg cyprofloksacyny oraz 250 mg cefaleksyny. U pacjentek uczulonych na sulfonamidy można stosować sam trimetoprim w dawce 80 mg.
Nitrofurantoina jest bardzo użytecznym środkiem profilaktycznym, zwłaszcza ze względu na skuteczność przeciwko wielu szczepom Escherichia coli wytwarzających β-laktamazę o rozszerzonym zakresie działania (ESBL) oraz mniejsze prawdopodobieństwo wywołania oporności, ale zasadniczo odradza się stosowanie tego leku u osób w podeszłym wieku ze względu na relatywnie większe ryzyko poważnych działań niepożądanych, w tym włóknienia płuc. Stosowanie nitrofurantoiny musi więc być poprzedzone uważną oceną stosunku korzyści do ryzyka. U kobiet po menopauzie, u których ZUM są wyraźnie związane z aktywnością seksualną, można zalecać profilaktykę po stosunku.
W kilku badaniach wykazano, że odpowiednio przeszkolone kobiety mogą wiarygodnie rozpoznawać objawy ZUM i rozpoczynać empiryczne leczenie. Koncepcja samodzielnie rozpoczynanego leczenia zakłada umożliwienie pacjentce podjęcia wczesnej interwencji w przypadku ZUM, które nawracają z umiarkowaną częstotliwością (3-6 razy rocznie). Pacjentce przepisuje się jeden lek i zaleca, aby w momencie wystąpienia pierwszych objawów zakażenia rozpoczęła leczenie i przeprowadziła jego pełny kurs – typowo przez 3 dni w przypadku niepowikłanego ZUM. Jeżeli objawy nie reagują szybko na leczenie lub wiążą się z gorączką, pacjentka musi niezwłocznie skontaktować się z lekarzem.
Samodzielnie rozpoczynane leczenie często zmniejsza niepokój chorej, skraca czas do rozpoczęcia leczenia i daje pacjentce poczucie kontroli. Należy jednak podkreślić, że tę strategię zaleca się tylko u dobrze współpracujących pacjentek, u których dokonano dokładnej oceny i przeprowadzono odpowiednie poradnictwo.
Podsumowanie
Nawracające ZUM u kobiet po menopauzie są częstym problemem, któremu można skutecznie przeciwdziałać, stosując kilkuetapowe podejście obejmujące uzyskanie danych z wywiadu i badań laboratoryjnych przemawiających za nawracającymi objawowymi ZUM, wykluczając utrzymywanie się obecności bakterii i nawrotów zakażenia, które wymagają dalszej diagnostyki, identyfikując i przeciwdziałając współistniejącym stanom przyczyniającym się do zakażenia, a także oferując pacjentce skuteczny sposób profilaktyki lub samodzielnie rozpoczynane leczenie. Omawiany problem należy odróżniać od bezobjawowej bakteriurii, która powinna być leczona zachowawczo, bez użycia antybiotyków.
Autorzy nie zgłosili konfliktów interesów odnoszących się do treści niniejszego artykułu.
Contemporary OB/GYN 2016;61(9):47-49
Komentarz
prof. dr hab. n. med. Jerzy Chudek
Artykuł omawia większość aspektów terapii nawracających zakażeń układu moczowego (ZUM) u chorych po menopauzie, z wyjątkiem immunoterapii, której skuteczność jest słabo udokumentowana badaniami klinicznymi.
Należy przypomnieć, że nawracające ZUM to trzy i więcej nawrotów zakażenia w ciągu roku u kobiet bez dodatkowych czynników ryzyka.
Niewątpliwie jednym z najlepiej udokumentowanych i uznanych działań profilaktycznych zmniejszających częstość nawrotów ZUM u kobiet po menopauzie jest miejscowe (dopochwowe) stosownie estrogenów.1 Skuteczność tej formy terapii jest następstwem przywrócenia prawidłowej biocenozy pochwy.2 Fizjologiczną barierą – zapobiegającą zakażeniom cewki moczowej i wtórnie wstępującym zakażeniom pęcherza moczowego – jest mikroflora pochwy, która zawiera około 100 typów bakterii tlenowych i beztlenowych. Zmniejszenie ilości wydzieliny pokrywającej błonę śluzową pochwy po menopauzie zaburza równowagę między bakteriami tlenowymi i beztlenowymi, a wśród nich pałeczek wytwarzających kwas mlekowy z rodzaju Lactobacillus. Te bakterie wytwarzają nadtlenek wodoru i kwas mlekowy, które odgrywają kluczową rolę w utrzymaniu prawidłowej mikroflory pochwy i ograniczają nadmierny wzrost innych bakterii. Adhezja pałeczek kwasu mlekowego do nabłonka okolic intymnych blokuje również dostęp bakteriom chorobotwórczym,3 w tym uropatogennym szczepom Escherichia coli. Zarówno dopochwowe, jak i doustne probiotyki ginekologiczne zawierające szczepy Lactobacillus są stosowane w leczeniu dysbiozy pochwy w okresie po menopauzie.
Stosowanie probiotyków zawierających liofilizowane szczepy Lactobacillus ze względu na występujące różnice między populacjami kobiet w różnych krajach powinno być dostosowane do danej populacji. U Polek dominują bakterie z rodzaju Lactobacillus, takie jak: L. acidophilus (35%), L. gasseri, L. fermentum (30%), L. plantarum (30%), L. delbrueckii, L. rhamnosus (5%), w niewielkich ilościach występuje także L. casei.4 Dlatego w Polsce zaleca się stosowanie innych niż w Stanach Zjednoczonych szczepów probiotycznych, tzn. preparatów zawierających szczepy rodzime L. gasseri 57C, L. fermentum 57B, L. plantarum 57A. Skuteczność probiotyków zawierających te szczepy została potwierdzona klinicznie. Jak to podkreślają autorzy komentowanego artykułu, taka forma profilaktyki jest atrakcyjna zwłaszcza dla kobiet preferujących metody naturalne i unikających stosowania antybiotyków/chemioterapeutyków.
Warto również wspomnieć o immunoterapii, którą można zastosować, jeśli czynnikiem etiologicznym nawracających zakażeń jest Escherichia coli. Metoda ta opiera się na stosowaniu doustnym wyciągów ze szczepów Escherichia coli (OM-89). Doustne długotrwałe (trzymiesięczne) stosowanie tego wyciągu zwiększa odpowiedź komórkową układu immunologicznego.5 Wyciąg jest dostępny na rynku od ponad dwóch dekad. Wyniki badań randomizowanych zostały podsumowane w niedawno opublikowanym przeglądzie systematycznym.6 Autorzy tego przeglądu wskazują na niską jakość przeprowadzonych badań, małą liczebność ocenianych grup i krótki czas obserwacji, a tym samym brak silnych dowodów na zmniejszenie częstości nawrotowych ZUM. Obserwacje własne potwierdzają uzyskiwanie długotrwałych remisji u części kobiet z nawrotowymi ZUM.
Autorzy komentowanej pracy wspominają o ekstraktach i soku z żurawiny. Są one coraz bardziej popularne na polskim rynku, wypierając tradycyjne leki ziołowe. Wartościowe piśmiennictwo potwierdzające skuteczność tych leków jest jednak dość skromne.
Jeśli wszystkie te metody zawiodą, pozostaje długotrwałe stosowanie chemioterapeutyków (kotrimoksazolu u w dawce 240 mg raz na dobę lub 3 razy w tygodniu; trimetoprimu w dawce 100 mg raz na dobę; furazydyny w dawce 50-100 mg raz na dobę) lub antybiotyków (cefakloru – 250 mg raz na dobę; cefaleksyny – 250 mg raz na dobę; norfloksacyny – 200 mg raz na dobę).7 Należy zwrócić uwagę, że nitrofurantoina jest w Polsce niedostępna. Zamiast niej stosowana jest inna pochodna nitrofuranu – furazydyna. Decyzja o długotrwałym stosowaniu leków odkażających drogi moczowe powinna być rozważna i nienadużywana. Alternatywą dla takiej formy terapii jest krótkotrwałe (tak jak w niepowikłanym ZUM) stosowanie tych leków przez chore przy pierwszych objawach zakażenia. Wyjątek stanowią kobiety, u których zakażenie rozwija się gwałtownie i skąpoobjawowo. W takich wypadkach lepszym rozwiązaniem jest terapia ciągła.
Piśmiennictwo
1. Rahn DD, Carberry C, Sanses TV, et al. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014;124:1147-56.
2. Muhleisen AL, Herbst-Kralovetz MM. Menopause and the vaginal microbiome. Maturitas. 2016;91:42-50.
3. Redondo-Lopez V, Cook RL, Sobel JD. Emerging role of lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infec Dis. 1990;12:856-72.
4. Peterek J. Ekosystem pochwy. Med Wieku Rozwoj. 2002;6(3):Suppl.1.
5. Rosenthal M. Effect of a bacterial extract on cellular and humoral immune responses in humans. J Immunopharmacol. 1986;8:315-25.
6. Taha Neto KA, Nogueira Castilho L, Reis LO. Oral vaccine (OM-89) in the recurrent urinary tract infection prophylaxis: a realistic systematic review with meta-analysis. Actas Urol Esp. 2016;40:203-8.
7. Holecki M, Chudek J. Standardy leczenia zakażeń układu moczowego. Med Dypl. 2016;7-8: 52-8.