Choroba niedokrwienna serca
Jak oceniać niedokrwienie i żywotność mięśnia sercowego – przydatność rezonansu magnetycznego, echokardiografii obciążeniowej i badań z zakresu medycyny nuklearnej
Anna Teresińska,1 Łukasz Małek,2 Anna Klisiewicz3
Wprowadzenie
Istnieje kilka nieinwazyjnych metod oceny niedokrwienia i żywotności mięśnia sercowego, m.in. echokardiografia obciążeniowa, badania medycyny nuklearnej oraz rezonans magnetyczny serca. Techniki te koncentrują się na różnych aspektach żywotności: badanie echokardiograficzne na rezerwie kurczliwości, SPECT na perfuzji i ciągłości błon komórkowych, PET na metabolizmie, a rezonans magnetyczny – na obecności blizny i rezerwie kurczliwości. W artykule zostaną omówione poszczególne metody z uwzględnieniem sposobu oceny niedokrwienia i żywotności, zalet oraz ograniczeń każdego z badań.
Rezonans magnetyczny serca
Do podstawowych zalet rezonansu magnetycznego serca (cardiovascular magnetic resonance, CMR) niezwiązanych z samą oceną niedokrwienia czy żywotności należy brak narażania pacjenta na promieniowanie jonizujące, niezmiernie rzadko występujące reakcje alergiczne na stosowane gadolinowe środki kontrastowe oraz brak istotnego wpływu tych środków na czynność filtracyjną nerek (eGFR), a także możliwość obrazowania serca w dowolnej płaszczyźnie. Dodatkowym atutem jest duża powtarzalność wyników między osobami opisującymi badanie [1].
Metoda nie jest jednak wolna od ograniczeń. Pacjent musi być we względnie stabilnym stanie klinicznym (badanie trwa ok. 30-45 minut), nie może mieć niektórych metalowych elementów w ciele (np. stymulatora serca, kardiowertera-defibrylatora), a w przypadku badań z użyciem środka kontrastowego eGFR powinna przekraczać 30 ml/min. Poniżej tej wartości nie należy podawać gadolinowych środków kontrastowych ze względu na ryzyko wystąpienia nefrogennego włóknienia systemowego. Nie oznacza to jednak, że u pacjentów ze schyłkową niewydolnością nerek nie można ocenić niedokrwienia lub żywotności mięśnia sercowego. Należy wówczas oprzeć się na próbach z dobutaminą. Problemy w ocenie może także stwarzać znaczna niemiarowość rytmu serca (migotanie przedsionków, liczne komorowe zaburzenia rytmu).
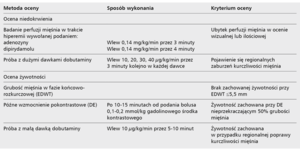
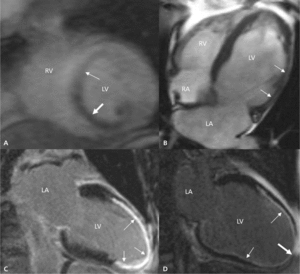
Najczęściej stosowane sposoby oceny niedokrwienia oraz żywotności mięśnia sercowego za pomocą CMR przedstawiono w tabeli 1.Przykłady niektórych badań zaprezentowano na rycinie 1.
Ocena niedokrwienia mięśnia sercowego
Ocena niedokrwienia mięśnia sercowego opiera się na dwóch metodach [2]. Pierwszą z nich jest tzw. badanie perfuzji, czyli ocena ubytków perfuzji mięśnia w trakcie pierwszego przejścia środka kontrastowego przez miokardium na szczycie hiperemii wywołanej wlewem adenozyny (krótsze działanie) lub dipirydamolu (dłuższe działanie). Nowym środkiem, który może znaleźć zastosowanie w niedalekiej przyszłości jest podawany w bolusie regadenozon, który powoduje szybkie wystąpienie hiperemii i jej utrzymywanie się przez dłuższy czas niż w przypadku adenozyny (czas półtrwania 2-3 minuty w porównaniu do 30 sekund dla adenozyny). W celach porównawczych oraz różnicowania z artefaktami badanie można uzupełnić o ocenę pierwszego przejścia środka kontrastowego przez mięsień sercowy w spoczynku, nie jest to jednak bezwzględnie wymagane. W codziennej praktyce ubytki perfuzji ocenia się najczęściej wizualnie z uwzględnieniem podziału na 17 segmentów lewej komory (left ventricle, LV) wg American Heart Association (AHA), ale istnieją także metody analizy ilościowej. Są one jednak pracochłonne i wymagają dodatkowego oprogramowania, a ponieważ nie charakteryzują się większą dokładnością diagnostyczną, pozostają mniej przydatne klinicznie. Należy zaznaczyć, że ocena wizualna umożliwia określenie, czy obszar niedokrwienia przekracza 10% masy LV, co wpływa na decyzję o rewaskularyzacji wieńcowej. Badanie w zależności od źródła cechuje się ok. 85-90% czułością i 75-85% swoistością w rozpoznawaniu istotnych zmian w tętnicach wieńcowych ocenianych za pomocą koronarografii [2]. W największych dotychczas opublikowanych prospektywnych badaniach klinicznych (MR-IMPACT, CE-MARC) ocena perfuzji za pomocą CMR przewyższała SPECT w diagnostyce choroby wieńcowej zarówno u pacjentów z chorobą jedno-, jak i wielonaczyniową [3,4]. Ograniczenie dla zastosowania adenozyny i dipirydamolu stanowią astma oskrzelowa oraz bloki przewodzenia przedsionkowo-komorowego (przed badaniem należy wykonać spoczynkowe EKG). Ważne jest, aby przez 24 godziny przed badaniem pacjent wstrzymał się od przyjmowania pokarmów i płynów zawierających pochodne ksantyny, takich jak kawa, herbata, napoje energetyczne, cola, czekolada, kakao. Ze względu na konieczność podania środka kontrastowego należy także oznaczyć stężenie kreatyniny.
Drugą metodą oceny niedokrwienia jest tzw. próba z dużymi dawkami dobutaminy, czyli ocena indukowanych wlewem wzrastających dawek dobutaminy regionalnych zaburzeń kurczliwości mięśnia. Stanowi ona alternatywę dla badania perfuzji, szczególnie u pacjentów ze schyłkową niewydolnością nerek. Idea badania jest taka sama jak w przypadku echokardiografii, przy czym CMR jest wolny od ograniczeń obrazowania. Metoda ta cechuje się nieco większą czułością, przy nieco mniejszej swoistości w rozpoznawaniu choroby wieńcowej w porównaniu z oceną perfuzji [2]. Minusem jest dłuższy czas trwania badania w porównaniu z czasem oceny perfuzji.
Ocena żywotności mięśnia sercowego
Żywotność dysfunkcyjnych obszarów miokardium można ocenić na kilka sposobów. CMR cechuje się dokładnością diagnostyczną porównywalną z echokardiografią czy SPECT [5].
Najprostszą metodą jest analiza grubości mięśnia w fazie końcowo-rozkurczowej (end-diastolic wall thickness, EDWT), w której za kryterium odcięcia przyjmuje się wartość 5,5 mm [6]. U ponad 90% pacjentów z mniejszą grubością mięśnia nie dojdzie do poprawy czynności skurczowej po rewaskularyzacji (duża ujemna wartość prognostyczna [negative predictive value, NPV]). Ograniczeniem tej prostej metody jest bardzo mała dodatnia wartość prognostyczna (positive predictive value, PPV) – poprawa występuje jedynie u ok. 50% chorych z EDWT >5,5 mm [5]. Przydatność oceny EDWT ogranicza także mniejsza rozdzielczość przestrzenna CMR (1,5 × 1,5 mm) w porównaniu z echokardiografią, co znacznie wpływa na miarodajność analizy EDWT. Istnieją także prace dowodzące, że niektórzy pacjenci z EDWT ≤5,5 mm mają zachowaną żywotność mięśnia [7]. Podsumowując, metoda ta nie jest wystarczająca do oceny żywotności.
Najczęściej stosowana technika analizy żywotności polega na ocenie tzw. późnego wzmocnienia pokontrastowego (delayed enhancement, DE). W obrębie cechującej się dużą objętością przestrzeni pozakomórkowej blizny pozawałowej dochodzi do zalegania podanego do żyły obwodowej gadolinowego środka kontrastowego (substancji pozakomórkowej), co powoduje charakterystyczne wzmocnienie tego obszaru mięśnia (jaśniejszy kolor w skali odcieni szarości) po ok. 10-15 minutach. W praktyce o zachowanej żywotności mówi się, gdy w danym segmencie grubość obszaru DE nie przekracza 50% grubości mięśnia [8]. Oceniono, że przy tak zdefiniowanym punkcie odcięcia NPV testu (tzn. brak poprawy czynności skurczowej po rewaskularyzacji przy DE ≥50%) wynosi ok. 80% [5,9]. Nieco niższa jest za to wartość PPV (tzn. poprawa czynności skurczowej po rewaskularyzacji przy DE <50%), która wynosi ok. 70% [5,9]. Badanie z samym środkiem kontrastowym (podobnie do EDWT) nie pozwala ocenić, czy dysfunkcyjny obszar mięśnia z DE obejmującym <50% grubości ściany posiada rezerwę skurczową.
Odpowiedź na to pytanie może przynieść kolejna metoda oceny żywotności (a właściwie oceny rezerwy skurczowej) polegająca na analizie poprawy kurczliwości dysfunkcyjnego obszaru mięśnia pod wpływem wlewu małej dawki dobutaminy (tzw. próba z małą dawką dobutaminy). Technikę tę cechuje podobna NPV, ale nieco wyższa PPV w stosunku do oceny DE (ok. 80%) [5,9].
Przy granicznych wartościach DE (25-75%) zaleca się połączenie obu metod i wykonanie oceny żywotności za pomocą DE oraz próby z dobutaminą [1]. W praktyce takich sytuacji jest jednak niewiele, ponieważ w celu kwalifikacji do rewaskularyzacji mięśnia ocenę pojedynczych segmentów należy odnieść do poszczególnych ścian lewej komory (6-7 segmentów), a grubość warstwy DE rzadko pozostaje graniczna we wszystkich ocenianych segmentach (ryc. 1D).
Echokardiografia obciążeniowa
Echokardiografia obciążeniowa z uwagi na nieinwazyjność, ogólną dobrą dostępność i stosunkowo mały koszt przy dużej czułości i swoistości zajęła trwałe miejsce w rozpoznawaniu niedokrwienia i żywotności mięśnia sercowego [10].