Inhibitory receptora trombinowego – PAR-1
Nowe leki z grupy inhibitorów receptora P2Y12 wykazują większą skuteczność w zmniejszaniu częstości powikłań niedokrwiennych w porównaniu z klasycznym połączeniem ASA z klopidogrelem. Jednak sam mechanizm blokowania aktywności płytek pozostaje głównym ograniczeniem działania wszystkich wymienionych leków, ponieważ każdy z nich blokuje pojedynczy szlak aktywacji – inhibitory P2Y12 hamują jedynie ADP-zależną agregację płytek, pozwalając na ich aktywację przez inne mechanizmy (np. przez trombinę). Ostatnio opublikowano dane dotyczące nowych leków przeciwpłytkowych o odmiennym mechanizmie blokowania aktywności płytek – inhibitorów receptora trombinowego PAR-1 (worapaksar, atopaksar) – z nadzieją na hamowanie aktywności płytek stymulowanej przez trombinę i tym samym zmniejszenie ryzyka niedokrwiennego bez podnoszenia ryzyka krwawień. Co istotne, trombina jest uważana za najsilniejszy aktywator płytek krwi i odgrywa główną rolę w tworzeniu zakrzepów na owrzodziałej lub pękniętej blaszce miażdżycowej.
Worapaksar
Worapaksar (wcześniej SCH530348) jest syntetyczną pochodną himbacyny stosowaną w postaci doustnej, charakteryzującą się wysoką biodostępnością. Działanie leku w stosunku do receptora PAR-1 jest kompetytywne, selektywne i odwracalne. W badaniach przedklinicznych nie obserwowano znaczącego wpływu tego leku na szlak koagulacji oraz parametry krzepnięcia, które mogłyby wskazywać na zwiększone ryzyko krwawienia. W badaniu TRA-PCI (badanie II fazy) waropaksar stosowany w połączeniu z ASA i klopidogrelem nie zwiększał ryzyka krwawienia określanego skalą TIMI u pacjentów poddawanych planowej PCI [35]. Obserwowano korzystny trend w zmniejszaniu ryzyka zgonów i incydentów sercowo-naczyniowych (szczególnie zawałów) w grupie stosującej worapaksar. W badaniu nie obserwowano także zwiększonego ryzyka krwawień u pacjentów poddawanych CABG. Worapaksar hamował aktywację płytek indukowaną przez trombinę, nie wpływając na agregację na skutek stymulacji ADP, kwasem arachidonowym i kolagenem. Podobnie w japońskiej populacji pacjentów z OZW bez uniesienia odcinka ST poddawanych zabiegom PCI potwierdzono korzyści wynikające ze stosowania worapaksaru bez zwiększania ryzyka krwawień [36]. Ostatnio opublikowano badania III fazy – TRACER [37] i TRA 2P-TIMI50 [38]. Badanie TRACER było ukierunkowane na prewencję łącznie zgonów z przyczyn sercowo-naczyniowych, zawałów serca, udarów mózgu, nawrotowego niedokrwienia serca czy potrzeby pilnej rewaskularyzacji u pacjentów z OZW bez uniesienia odcinka ST leczonych połączeniem ASA i klopidogrelu. Opublikowane pod koniec 2011 r. dane nie potwierdziły jednak korzyści z dodatkowego zastosowania worapaksaru (mediana czasu trwania terapii 502 dni) w porównaniu ze standardowym leczeniem: pierwotny punkt końcowy nie został istotnie statystycznie zredukowany (worapaksar vs placebo: 18,5 vs 19,9%, HR 0,92, 95% PU 0,85-1,01, p=0,07), natomiast obserwowano zwiększone ryzyko umiarkowanych i dużych krwawień (7,2 vs 5,2%, HR 1,35, 95% PU 1,16-1,58, p <0,001), w tym krwawień wewnątrzczaszkowych (1,1 vs 0,2%, HR 3,39, 95% PU 1,78-6,45, p <0,001) [37]. W badaniu TRA 2P-TIMI50 oczekiwano, że worapaksar stosowany w ramach prewencji wtórnej u 26 000 pacjentów z przebytym zawałem mięśnia sercowego, udarem niedokrwiennym mózgu czy miażdżycą naczyń obwodowych przyniesie korzyści kliniczne [38]. Jednak po dwóch latach obserwacji badanie zostało przerwane w grupie pacjentów z wcześniej przebytym udarem mózgu z powodu zwiększonego ryzyka krwawień wewnątrzczaszkowych. Badanie kontynuowano do 3 lat w grupach pacjentów z przebytym zawałem mięśnia sercowego i miażdżycą naczyń obwodowych, wykazując jednocześnie korzyści kliniczne – zmniejszenie częstości zgonów z przyczyn sercowo-naczyniowych i incydentów niedokrwiennych. Mimo istotnej redukcji pierwotnego punktu końcowego, obejmującego zgon z przyczyn sercowo-naczyniowych, zawał mięśnia sercowego i udar mózgu (worapaksar vs placebo: 9,3 vs 10,5%, HR 0,87, 95% PU 0,80-0,94, p <0,001), zastosowanie worapaksaru w celu prewencji wtórnej incydentów sercowo-naczyniowych wiązało się ze zwiększonym ryzykiem umiarkowanych i dużych krwawień (4,2 vs 2,5%, HR 1,66, 95% PU 1,43-1,93, p <0,001), w tym krwawień wewnątrzczaszkowych (1,0 vs 0,5%, p <0,001). W związku z metabolizmem leku przez układ cytochromu P-450 jego działanie może być modulowane przez inne leki, będące silnymi inhibitorami (np. ketokonazol) lub induktorami (np. ryfampicyna) układu cytochromu P-450.
Atopaksar
Atopaksar (wcześniej E5555), podobnie jak worapaksar, jest doustnym, selektywnym i odwracalnym antagonistą receptora PAR-1. W porównaniu z worapaksarem charakteryzuje się dłuższym czasem do rozpoczęcia działania i krótszym czasem półtrwania. Nie wpływa na czas krzepnięcia i krwawienia. Do tej pory jego skuteczność i bezpieczeństwo oceniano w trzech badaniach II fazy. Pierwsze z nich, J-LANCELOT, objęło 241 pacjentów z OZW bez uniesienia odcinka ST (obserwacja 12-miesięczna) oraz 263 pacjentów z chorobą niedokrwienną serca dużego ryzyka (obserwacja 24-miesięczna) [39]. Pacjentów losowo przydzielono do 4 grup (3 grupy leczone aktywnie 50, 100 lub 200 mg atopaksaru oraz grupa placebo). W badaniu nie wykazano istotnych różnic między grupami w częstości krwawień i incydentów sercowo-naczyniowych. Zwiększanie dawki atopaksaru nasilało wpływ antyagregacyjny leku, jednak prowadziło do narastania ryzyka powikłań krwotocznych. W grupie pacjentów przyjmujących największą dawkę leku (200 mg) stwierdzano ponadto zwiększenie ryzyka wystąpienia zaburzeń funkcji wątroby związanych z przyjmowaniem leku.
Kolejnymi badaniami oceniającymi skuteczność leczenia atopaksarem w porównaniu z placebo były LANCELOT-ACS (603 pacjentów) i LANCELOT-CAD (720 pacjentów) [40,41]. W obu zastosowanie atopaksaru wiązało się z nieistotnym statystycznie wzrostem ryzyka krwawień, bez istotnego wpływu na częstość incydentów sercowo-naczyniowych. W podgrupie pacjentów z OZW stosowanie inhibitora receptora trombinowego istotnie zmniejszało częstość incydentów niedokrwienia zarejestrowanych w monitorowaniu EKG metodą Holtera. W związku z krótszym czasem półtrwania atopaksar może być preferowany u pacjentów, u których istnieje ryzyko konieczności pilnego zabiegu operacyjnego.
W łącznej analizie przedstawionych badań z zastosowaniem worapaksaru i atopaksaru, zastosowanie inhibitora receptora trombinowego wiązało się z istotnym zmniejszeniem śmiertelności z przyczyn sercowo-naczyniowych oraz obniżeniem ryzyka ponownego zawału mięśnia sercowego, ale przy wydatnym wzroście ryzyka powikłań krwotocznych [42]. Perspektywa kliniczna dla powyższych leków nie jest jednoznaczna. Są to skuteczne leki, hamujące dodatkowy mechanizm aktywacji płytek, ale zwiększający ryzyko krwawienia, w tym krwawień wewnątrzczaszkowych (worapaksar) u chorych przyjmujących podwójną terapię przeciwpłytkową. Zablokowanie kilku szlaków aktywacji płytek przez kilka równolegle przyjmowanych leków przeciwpłytkowych (ASA, inhibitory P2Y12, inhibitor PAR-1) może dawać efekt podobny do całkowitego blokowania płytek przez inhibitory receptora płytkowego GP IIb/IIIa,
które w postaci doustnej nie znalazły zastosowania klinicznego właśnie z powodu zwiększonego ryzyka krwawień. Aktualne badania będą nakierowane prawdopodobnie na określenie przydatności tej grupy leków nie jako dodatku do standardowej terapii przeciwpłytkowej, a jej alternatywy. Trwają również prace nad nowymi cząsteczkami działającymi na receptor PAR-1. Na przykład cząsteczka F121958 oprócz wpływu na trombinowy szlak aktywacji płytek krwi wykazuje działanie hamujące na inne szlaki oraz dzięki wpływowi na mięśniówkę gładką naczynia zapobiega jego obkurczaniu w następstwie jego uszkodzenia, limitując w ten sposób niedokrwienie mięśnia sercowego.
Nowe leki przeciwpłytkowe – które i u kogo stosować?
Spośród omówionych leków nowej generacji jedynie prasugrel i tikagrelor są lekami zarejestrowanymi przez EMA i dopuszczonymi do obrotu w Unii Europejskiej. Są one ponadto lekami rekomendowanymi przez wytyczne towarzystw kardiologicznych do rutynowego stosowania u pacjentów z OZW (tabela) [1-5]. Zostały również wskazane do szerszego zastosowania w Polsce w stanowisku Polskiego Towarzystwa Kardiologicznego z września 2011 r. [43,44].
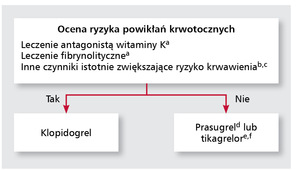
Rycina. Schemat wyboru antagonisty receptora P2Y12 w zależności od charakterystyki klinicznej pacjenta z ostrym zespołem wieńcowym.
Terapia prasugrelem może być alternatywą dla klopidogrelu u chorych z OZW z uniesieniem i bez uniesienia odcinka ST z klasą zaleceń I i poziomem dowodów B. Brakuje wskazań dotyczących stosowania tego leku u pacjentów ze stabilną dławicą piersiową, w tym również chorych poddawanych zabiegowi PCI. Prasugrel stosuje się łącznie z ASA w dawce nasycającej 60 mg i podtrzymującej 10 mg, a u osób <60 kg lub>75 r.ż. zaleca się zmniejszenie dawki do 5 mg. Jest on szczególnie zalecany w STEMI, u chorych z cukrzycą i po przebytym, mimo leczenia klopidogrelem, incydencie zakrzepicy w stencie. Prasugrel jest przeciwwskazany u osób po przebytym udarze (niedokrwiennym lub krwotocznym) lub epizodzie TIA. Ze względu na większe ryzyko krwawień jego zastosowanie u pacjentów >75 r.ż. powinno być rozpatrywane indywidualnie po ocenie spodziewanych korzyści i ryzyka terapii (rycina). Pewne wątpliwości budzi moment podania leku (przed badaniem koronarograficznym czy po nim). Zgodnie z protokołem badania TRITON-TIMI-38 u pacjentów z OZW bez uniesienia odcinka ST był on stosowany dopiero po badaniu angiograficznym u chorych kwalifikowanych do PCI. Natomiast w przypadku pacjentów ze STEMI mógł on być stosowany przed koronarografią. Wytyczne europejskie nie precyzują dokładnie czasu podania prasugrelu u pacjentów z OZW [1,2]. Zalecenia towarzystw amerykańskich wskazują natomiast, podobnie jak w przypadku klopidogrelu, by podanie leku u pacjentów ze STEMI kierowanych do PCI nastąpiło jak najwcześniej [4]. W przypadku pacjentów z OZW bez uniesienia odcinka ST dają one natomiast niższą klasę zaleceń dla podania leku przed angiografią (IIb/C) niż w przypadku pacjentów poddawanych PCI (I/B) (tabela) [5]. Dodatkowych informacji dostarczy z całą pewnością toczące się aktualnie badanie ACCOAST, porównujące możliwość wczesnego zastosowania prasugrelu przed badaniem koronarograficznym, do jego podania po badaniu koronarograficznym u pacjentów z zawałem mięśnia sercowego bez uniesienia odcinka ST [45]. Kolejnym zagadnieniem pozostaje możliwość stosowania prasugrelu u pacjentów, którzy już otrzymali dawkę wysycającą klopidogrelu. Ta grupa chorych nie była włączana do badania TRITON-TIMI-38. W świetle danych z omówionego powyżej badania TRIPLET podanie dawki wysycającej prasugrelu u pacjentów już leczonych klopidogrelem wydaje się bezpieczne i daje mocniejszy efekt przeciwpłytkowy terapii.
Tikagrelor stosuje się w dawce nasycającej 180 mg, a następnie podtrzymującej 2 × 90 mg (w połączeniu z ASA). Jest on zalecany u chorych z OZW leczonych inwazyjnie i zachowawczo (klasa zaleceń I/B). Redukcja dawki u osób w wieku podeszłym lub małą wagą nie jest wymagana. Mimo braku jednoznacznych przeciwwskazań zaleca się ostrożność w przypadku stosowania leku u pacjentów po przebytym udarze niedokrwiennym lub epizodzie TIA [5]. W przypadku chorych po przebytym udarze krwotocznym jest on bezwzględnie przeciwwskazany. Może być stosowany przed badaniem angiograficznym, a także w przypadku chorych leczonych uprzednio klopidogrelem. Jednak podobnie jak w przypadku prasugrelu, wiedza o skuteczności i bezpieczeństwie takiego postępowania jest ograniczona, ponieważ w badaniu PLATO wśród pacjentów z STEMI dawkę wysycającą 600 i 300 mg przed randomizacją otrzymało odpowiednio 21,3 i 17,8% pacjentów przydzielonych do leczenia tikagrelorem. Należy pamiętać, że w Polsce prawie 1/3 pacjentów z rozpoznaniem STEMI kierowanych do diagnostyki i leczenia inwazyjnego nie otrzymuje dawki wysycającej klopidogrelu w fazie przedszpitalnej [44]. W tej grupie chorych zaleca się stosowanie nowych leków przeciwpłytkowych (prasugrel, tikagrelor) w pracowni hemodynamiki w celu uzyskania szybszego i pełniejszego działania przeciwpłytkowego – zgodnie z modelem B przedstawionym w Kardiologii Polskiej w 2011 r. [43]. Aktualnie toczą się badania dotyczące możliwości przesunięcia inicjacji leczenia nowymi lekami przeciwpłytkowymi do fazy przedszpitalnej. Badanie ATLANTIC ocenia na przykład skuteczność podania tikagreloru przed transportem do pracowni hemodynamiki w porównaniu z podaniem leku przy przyjęciu u pacjentów z STEMI leczonych pierwotną PCI.
Brakuje badań bezpośrednio porównujących prasugrel i tikagrelor w terapii OZW. Dane z metaanalizy etapowej wskazują na większą skuteczność prasugrelu niż tikagreloru w zapobieganiu zakrzepicy w stencie wśród pacjentów poddawanych PCI, lecz także na większe ryzyko wystąpienia wszystkich poważnych powikłań krwotocznych, w tym tych związanych z CABG. Ryzyko powikłań krwotocznych wśród pacjentów niepoddawanych leczeniu kardiochirurgicznemu kształtowało się na zbliżonym poziomie [46]. Oba leki natomiast wykazują większą niż klopidogrel skuteczność w zapobieganiu wystąpieniu incydentów sercowo-naczyniowych. Warto podkreślić, że prasugrel i tikagrelor posiadają obecnie wyższy (I/B) niż klopidogrel (I/C) poziom rekomendacji, oparty na wynikach badań randomizowanych, a nie jedynie na opinii ekspertów [1-5]. Ostateczny wybór leku powinien opierać się na ocenie spodziewanego ryzyka powikłań krwotocznych (rycina). Warto jednak podkreślić, że różnica w rekomendacji dla poszczególnych leków nie jest wynikiem różnicy ich skuteczności potwierdzonej w badaniach randomizowanych, ale głównie odmiennością kryteriów włączenia i wyłączenia w poszczególnych protokołach już przeprowadzonych badań.
Zgodnie z przedstawionymi danymi połączenie ASA z prasugrelem lub tikagrelorem powinno być zalecane w szerokiej populacji pacjentów z OZW. Leki te mogą również znaleźć zastosowanie u pacjentów po przebytym incydencie zakrzepicy w stencie w trakcie leczenia klopidogrelem. Należy pamiętać również o możliwości łączenia ich z dożylnymi inhibitorami receptora płytkowego GPIIb/IIIa (efekt inhibitora GPIIb/IIIa nie zależy od działania nowych doustnych leków przeciwpłytkowych). Pozostałe omówione leki z grupy inhibitorów P2Y12 (kangrelor, elinogrel) oraz inhibitorów receptora trombinowego pozostają nadal w fazie badań klinicznych i nie znalazły się jeszcze w zaleceniach.
Nowe leki przeciwpłytkowe – jak długo stosować?
U pacjentów po przebytym OZW (zarówno z uniesieniem, jak i bez uniesienia odcinka ST) aktualne wytyczne zalecają stosowanie podwójnej terapii przeciwpłytkowej (ASA w połączeniu z jednym z leków – klopidogrel [75 mg na dobę], prasugrel [10 lub 5 mg na dobę], tikagrelor [2 × 90 mg na dobę]) przez 12 miesięcy od wystąpienia OZW. Zalecany czas terapii nie jest uwarunkowany modelem leczenia (rewaskularyzacja vs leczenie zachowawcze) ani rodzajem implantowanego stentu [1-5], przy czym w przypadku pacjentów leczonych zachowawczo preferowanymi lekami będą tikagrelor i klopidogrel, nie prasugrel. Czas terapii może być skrócony w przypadku chorych, u których spodziewane ryzyko krwawienia przewyższa korzyść wynikającą z ryzyka powikłań niedokrwiennych [5]. Wydłużenie leczenia ponad 12 miesięcy może pozwolić na dodatkowe zmniejszenie ryzyka powikłań niedokrwiennych przy jednoczesnym wzroście ryzyka krwawień. Potwierdzają to dane z badania CHARISMA, w którym przedłużona (mediana czasu trwania terapii 27,6 miesięcy) podwójna terapia przeciwpłytkowa ASA i klopidogrelem wiązała się z istotnym zmniejszeniem częstości incydentów sercowo-naczyniowych u pacjentów z miażdżycą objawową, w tym chorych po przebytym zawale mięśnia sercowego [47]. Terapia ta obarczona była jednak zwiększonym ryzykiem powikłań krwotocznych. Toczące się badanie PEGASUS ocenia, czy korzyść z przedłużonego stosowania tikagreloru u pacjentów po przebytym zawale mięśnia sercowego (1-3 lat po zawale) z dodatkowym czynnikiem ryzyka (m.in. podeszły wiek, cukrzyca, niewydolność nerek, choroba wielonaczyniowa) będzie przewyższała ryzyko krwawień związanych z jego podawaniem.
Biorąc pod uwagę nadal stosunkowo wysoką cenę leku dla pacjentów, mogą zdarzyć się sytuacje wymagające zamiany prasugrelu lub tikagreloru na klopidogrel w terapii przewlekłej. Takie postępowanie nie powinno być zalecane, ponieważ brakuje danych klinicznych pozwalających na ocenę bezpieczeństwa takiej zamiany leków. Z danych z badań oceniających stopień zahamowania agregacji płytek krwi możemy spodziewać się osłabienia efektu przeciwpłytkowego terapii przy zamianie prasugrelu lub tikagreloru na klopidogrel [18]. Z drugiej strony do zakrzepicy w stencie dochodzi najczęściej w okresie kilkunastu dni od jego implantacji, więc nawet krótkotrwała (przez miesiąc) terapia prasugrelem lub tikagrelorem może wiązać się z istotnym zmniejszeniem ryzyka powikłań niedokrwiennych w porównaniu z terapią klopidogrelem. Mimo braku danych naukowych dotyczących zamiany leków przeciwpłytkowych w przypadku konieczności przerwania przez pacjenta leczenia prasugrelem lub tikagrelorem ze względów finansowych należy kontynuować leczenie przeciwpłytkowe, stosując połączenie ASA i klopidogrelu przez zalecany czas (nie można akceptować przerwania podwójnej terapii przeciwpłytkowej).
O ile rodzaj implantowanego stentu wieńcowego nie determinuje zalecanego czasu trwania podwójnej terapii przeciwpłytkowej, wpływa on jednak na minimalną długość czasu jej prowadzenia. W przypadku implantacji stentów metalowych (bare-metal stent, BMS) zaleca się ją przez co najmniej 4-6 tygodni. W przypadku stentów pokrywanych lekiem antymitotycznym (drug eluting stents, DES) zalecany okres stosowania leku jest wydłużony do 12 miesięcy, a dotyczy to szczególnie stentów typu DES I generacji. W przypadku stentów II i III generacji wydaje się, że czas stosowania podwójnej terapii przeciwpłytkowej może być skrócony do 6 miesięcy. Dla stentów Xience – stentów kobaltowo-chromowych pokrywanych ewerolimusem – zgodnie z najnowszą rejestracją z 2012 r. podwójne leczenie przeciwpłytkowe musi być kontynuowane jedynie przez okres 3 miesięcy. Prawdopodobnie nowe wytyczne skrócą zalecany czas podwójnej terapii przeciwpłytkowej po implantacji DES nowej generacji. Przemawiają za tym również wyniki badań. W badaniu EXCELLENT nie wykazano różnic w rokowaniu pacjentów (ok. 50% pacjentów z OZW) leczonych podwójną terapią przeciwpłytkową po implantacji DES przez 6 vs 12 miesięcy [48]. Podobnie w badaniu PRODIGY nie obserwowano różnic w częstości powikłań niedokrwiennych u pacjentów poddawanych PCI (ok. 75% pacjentów leczonych DES, ok. 75% z rozpoznaniem OZW) i leczonych terapią podwójną przez 6 vs 24 miesięcy [49]. Co istotne, przedłużone leczenie przez 24 miesięcy obarczone było istotnie większym ryzykiem powikłań krwotocznych. Decyzja o rodzaju implantowanego stentu powinna być zawsze rozpatrywana indywidualnie w oparciu o spodziewane ryzyko powikłań krwotocznych związane z przedłużonym leczeniem przeciwpłytkowym. Powinno się unikać implantacji stentów typu DES u chorych planowanych do zabiegów chirurgicznych, których wykonanie nie można odroczyć do momentu zakończenia podwójnego leczenia przeciwpłytkowego. Gdy implantacja stentu jest konieczna, a wymagane jest znaczne skrócenie czasu trwania podwójnej terapii przeciwpłytkowej, można rozważyć implantację stentu Genous wychwytującego komórki progenitorowe śródbłonka [50]. Charakteryzuje się on szybszym niż w przypadku stentów BMS śródbłonkowaniem. Pierwsze doniesienia wskazują, że skrócenie czasu trwania podwójnej terapii przeciwpłytkowej do 10 dni nie wiąże się w ich przypadku ze wzrostem ryzyka powikłań niedokrwiennych, w tym zakrzepicy w stencie. Należy pamiętać, że stent tego typu nie jest równoznaczny stentowi DES i jego implantacja wiąże się z większym niż w przypadku stentów DES ryzykiem konieczności ponownej rewaskularyzacji mięśnia sercowego w obserwacji odległej. W przypadku kardiologów interwencyjnych obserwuje się obecnie trend do skracania czasu podwójnej terapii przeciwpłytkowej, co jest związane z traktowaniem jej jedynie jako środka zapobiegania zakrzepicy w stencie. Z drugiej strony toczą się badania dotyczące możliwości przedłużenia terapii przeciwpłytkowej jako elementu prewencji wtórnej, zapobiegania incydentom sercowo-naczyniowym często niezwiązanym z samym miejscem poszerzenia naczynia. Tym samym w przypadku każdego pacjenta powinniśmy mówić o zalecanym (warunkowanym rozpoznaniem) i minimalnym (warunkowanym rodzajem implantowanego stentu) czasie trwania podwójnej terapii przeciwpłytkowej. Czas rekomendowany i minimalny może być indywidualnie skrócony (wydłużony) w oparciu o ryzyko krwotoczne lub niedokrwienne pacjenta.