Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Kardiologia interdyscyplinarna
Wpływ ogólnoustrojowego procesu zapalnego i autoimmunizacji na progresję miażdżycy naczyń w chorobach tkanki łącznej
Wojciech Płazak,1 Jacek Musiał,2 Edyta Płońska-Gościniak,3 Piotr Podolec1
Definicja chorób układowych tkanki łącznej
Choroby układowe tkanki łącznej zostały wyodrębnione w 1941 roku jako zaburzenia ogólnoustrojowe o dużej różnorodności objawów klinicznych, których wspólną cechą w obrazie histopatologicznym, jak wówczas sądzono, jest martwica włóknikowa tkanki łącznej [1]. Obecnie do grupy tej zalicza się przede wszystkim tocznia rumieniowatego układowego (systemic lupus erythematosus, SLE), twardzinę układową (systemic sclerosis, SSc), zapalenie skórno-mięśniowe (dermatopolymyositis, DPM), reumatoidalne zapalenie stawów (rheumatoid arthritis, RA) oraz układowe zapalenia naczyń [2].
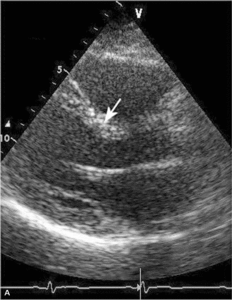
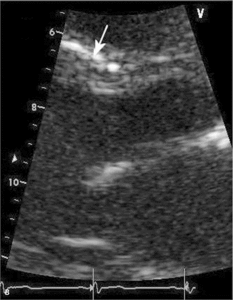
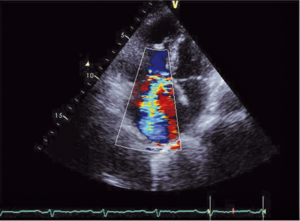
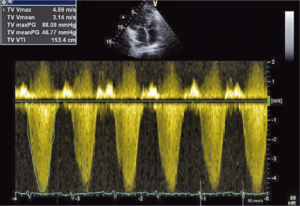
Głównym mechanizmem patogenetycznym twardziny układowej jest zwiększona produkcja aminopropeptydu kolagenu typu III, w następstwie czego dochodzi do włóknienia tkanek (ryc. 1). Zwiększenie sztywności naczyń koreluje z zaawansowaniem choroby [3-5] i może prowadzić do ciężkiego powikłania, jakim jest tętnicze nadciśnienie płucne (ryc. 2, 3) [6].
Choroby układowe tkanki łącznej, w których dominuje przewlekły proces zapalny, przede wszystkim toczeń rumieniowaty układowy, spowodowane są utratą tolerancji na własne antygeny. Reakcje zapalne typu komórkowego i humoralnego powodują uszkodzenia wielonarządowe [7]. W porównaniu z populacją ogólną u chorych z SLE obserwuje się przyspieszony rozwój miażdżycy naczyń. Dalsza część artykułu dotyczyć będzie zatem przede wszystkim chorych z toczniem rumieniowatym układowym.
Toczeń rumieniowaty układowy – częstość występowania, obraz kliniczny, rozpoznanie
W zależności od populacji częstość występowania SLE ocenia się na kilkanaście do kilkudziesięciu osób na 100 000, a rocznie odnotowuje się 1,8-7,6 nowych przypadków na 100 000 osób. U kobiet w wieku rozrodczym choroba występuje 10-krotnie częściej niż u mężczyzn. Obraz kliniczny SLE charakteryzuje się okresami zaostrzeń i remisji, zmiennym przebiegiem i różną manifestacją kliniczną. W kohorcie Toronto obejmującej 750 chorych [8] najczęściej obserwowano zmiany skórne (78%), objawy ogólne (zmniejszona tolerancja wysiłku, gorączka, spadek masy ciała, 77%), objawy zajęcia nerek (74%), zapalenia stawów (63%), zapalenia naczyń (56%) i objawy neurologiczne (53%). Ze względu na różnorodność manifestacji klinicznych ustalenie rozpoznania może być trudne. Opiera się ono na kryteriach Amerykańskiego Towarzystwa Reumatologicznego [9,10].
Wpływ zmian w układzie krążenia na rokowanie chorych z SLE
W 1976 r. Urowitz i wsp. [11] zaobserwowali, że częstą przyczyną śmierci pacjentów chorujących na SLE dłużej niż rok był zawał mięśnia sercowego, a nie bezpośrednie następstwa procesu autoimmunologicznego. Badania przeprowadzone od tego czasu wykazały, że jednym z ważniejszych czynników prognostycznych u chorych z SLE jest zajęcie serca spowodowane szybkim rozwojem zmian miażdżycowych oraz zakrzepami i zatorami tętnic wieńcowych. Wprowadzenie steroidoterapii przyczyniło się do znacznego zmniejszenia częstości występowania istotnych hemodynamicznie zmian morfologicznych we wsierdziu, przede wszystkim w płatkach zastawek, poważnym problemem pozostaje jednak duże ryzyko incydentów sercowo-naczyniowych, u podłoża których leży miażdżyca. Należy pamiętać, że kortykosteroidy, leki standardowo stosowane u chorych z SLE, powodują – zarówno w sercu zdrowym, jak i w przebiegu tocznia – zwiększenie ilości tkanki tłuszczowej w obrębie serca, przerost mięśnia serca oraz przyczyniają się do progresji miażdżycy [12]. W niektórych badaniach odsetek zgonów z przyczyn sercowo-naczyniowych (najczęściej z powodu zawału mięśnia sercowego) u chorych z toczniem wynosił 40% [13,14]. Ryzyko zawału mięśnia sercowego u kobiet w wieku 35-45 lat z toczniem układowym jest 50-krotnie większe niż w populacji ogólnej [15]. W większości przypadków SLE miażdżyca rozwija się bezobjawowo, a zawał może być jej pierwszą manifestacją [15].
Miażdżyca u chorych z SLE – czułość i swoistość metod diagnostycznych
Możliwość diagnostyki subklinicznych stadiów choroby w populacji ogólnej przyczynia się do identyfikacji osób, u których ryzyko wystąpienia powikłań sercowo-naczyniowych jest zwiększone [16]. W populacji chorych z SLE nie ma jednak zgodności co do wyboru najlepszej metody diagnostycznej, pozwalającej wykryć subkliniczną chorobę niedokrwienną serca. Koronarografia, jako badanie inwazyjne, nie może służyć jako metoda przesiewowa. Szeroko stosowany elektrokardiograficzny test wysiłkowy jest narzędziem niewystarczającym, w związku ze stosunkowo małą czułością (68%) i swoistością (77%), dlatego ok. 32% chorych z niedokrwieniem mięśnia serca nie zostaje zdiagnozowanych za pomocą tej metody [17]. W niedawnym polskim badaniu z udziałem 22 kobiet z SLE potwierdzono małą przydatność testu wysiłkowego w diagnostyce choroby niedokrwiennej serca w tej populacji [18]. Podobnie odcinkowe zaburzenia czynności skurczowej lewej komory w spoczynkowym badaniu echokardiograficznym widoczne są jedynie u chorych po zawale mięśnia sercowego, u których martwicy uległo przynajmniej 20% grubości mięśnia komory.
W piśmiennictwie podkreśla się dużą wartość prognostyczną scyntygrafii perfuzyjnej serca (SPECT) u chorych z chorobą wieńcową [19,20]. To nieinwazyjne badanie charakteryzuje się bardzo dużą czułością (91-100%) w wykrywaniu niedokrwienia [19,21]. W SLE badanie SPECT wskazuje na dużą częstość zaburzeń perfuzji miokardium [22,23], które stwierdza się u około połowy chorych mimo prawidłowych zapisów spoczynkowego EKG i braku klinicznych objawów niedokrwienia lub zaburzeń kurczliwości odcinkowej lewej komory [24]. Niewielkie ubytki perfuzji mają zazwyczaj charakter trwały i występują zarówno w spoczynku, jak i podczas wysiłku [24]. Obok zaburzeń perfuzji mięśnia serca u prawie połowy bezobjawowych chorych z SLE stwierdza się uwapnione zmiany miażdżycowe w tętnicach. Ze wszystkich łożysk naczyniowych tętnice wieńcowe są najczęściej dotknięte miażdżycą. W ostatnio opublikowanym badaniu 50 chorych z SLE częstość występowania zmian miażdżycowych uwidocznionych metodą wielorzędowej tomografii komputerowej była największa w tętnicach wieńcowych (42% chorych ze zmianami), a następnie w tętnicach szyjnych (24% chorych ze zmianami) [25].
Znaczenie wskaźnika uwapnienia tętnic (calcium score) obliczanego na podstawie wielorzędowej tomografii komputerowej jako parametru rokowniczego u chorych bezobjawowych o umiarkowanym ryzyku powikłań choroby niedokrwiennej serca jest w ostatnim czasie intensywnie badane [26,27]. Dotychczasowe dane wykazują, że obecność zwapnień w tętnicach wieńcowych jest istotnym krótko- i długoterminowym czynnikiem prognostycznym wystąpienia zdarzeń sercowo-naczyniowych [28-30]. Nawet u chorych z prawidłowym wynikiem badania SPECT podwyższony wskaźnik uwapnienia tętnic wieńcowych związany z obecnością małych, nieistotnych hemodynamicznie zmian miażdżycowych identyfikuje osoby o wysokim długoterminowym ryzyku sercowym [28]. Wskaźnik uwapnienia wynoszący zero świadczy o bardzo małym ryzyku, nawet w populacjach o dużym zagrożeniu związanym z występowaniem innych chorób, np. cukrzycy [31].
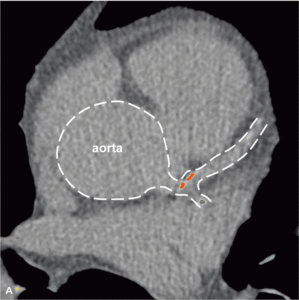
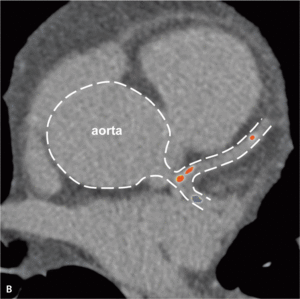
Rycina 4. Progresja zmian miażdżycowych w tętnicach wieńcowych u bezobjawowego chorego z toczniem rumieniowatym układowym w rocznej obserwacji.
Czynniki mogące zwiększać częstość występowania obserwowanych zaburzeń perfuzji miokardium i przyspieszać rozwój zmian miażdżycowych u chorych z SLE zostały omówione poniżej. W tym miejscu należy jednak wspomnieć, że przeciwciała antyfosfolipidowe obecne u chorych z SLE mogą być przyczyną epizodów mikrozatorowości tętniczej w krążeniu wieńcowym [32]. Epizody zakrzepowo-zatorowe mogą prowadzić do ograniczonych przestrzennie, trwałych ubytków perfuzji miokardium. Podłoże zakrzepowo-zatorowe zaburzeń mikrokrążenia wieńcowego może także potwierdzić porównaniem wyników badań SPECT i MSCT. Uwapnione blaszki miażdżycowe w tętnicach wieńcowych stwierdzane są znacznie rzadziej niż zaburzenia perfuzji mięśnia serca, co wskazuje na pozamiażdżycową patogenezę zaburzeń perfuzji u części chorych.
Przyczyny szybkiej progresji miażdżycy w SLE
Badania obrazowe dowiodły, że mimo stabilnego okresu choroby oraz małej podtrzymującej dawki kortykosteroidów u młodych chorych z SLE miażdżyca tętnic wieńcowych postępuje szybko [33]. Rycina 4 przedstawia progresję zmian miażdżycowych uwidocznioną metodą wielorzędowej tomografii komputerowej, do której doszło u bezobjawowego chorego z SLE w rocznej obserwacji. Duże ryzyko objawowej postaci choroby niedokrwiennej serca obserwowane już u młodych chorych z SLE pozwala przypuszczać, że obecność klasycznych czynników ryzyka miażdżycy nie stanowi w tej grupie głównego mechanizmu patogenetycznego. Zgodnie z oczekiwaniami wykazano brak istotnego wpływu otyłości, nadciśnienia tętniczego, palenia tytoniu, hiperlipidemii lub cukrzycy na obecność i nasilenie zwapnień w tętnicach wieńcowych oraz zaburzeń perfuzji mięśnia serca [24]. Uogólniony proces zapalny, manifestujący się podwyższeniem stężenia białka CRP oraz obniżeniem stężenia składowych C3c i C4 układu dopełniacza, nie wpływa istotnie na rozwój zmian miażdżycowych w młodym wieku [24], chyba że stężenie CRP jest przewlekle istotnie podwyższone i przekracza 20 mg/l [34].
U chorych z SLE z zaburzeniami perfuzji miokardium oraz zmianami miażdżycowymi w tętnicach wieńcowych znaczenie klasycznych czynników ryzyka choroby wieńcowej jest małe, stwierdzono u nich jednak wzmożoną autoimmunizację, wyrażającą się podwyższeniem stężenia przeciwciał antyfosfolipidowych, przede wszystkim przeciwciał antykardiolipinowych (aCL) klasy IgG oraz przeciwciał przeciw β2-glikoproteinie I (antyβ2GPI) klasy IgG [24]. W ostatnich publikacjach wzrasta zainteresowanie wpływem reakcji autoimmunologicznych na inicjowanie oraz przyspieszenie procesu depozycji lipidów i formowania blaszki miażdżycowej [35]. Wśród przeciwciał antyfosfolipidowych główną rolę w patogenezie miażdżycy przypisuje się właśnie przeciwciałom aCL i antyβ2GPI [36]. W badaniach in vitro wykazano, że w przypadku obecności przeciwciał aCL przeciwciała antyβ2GPI przyspieszają ich wiązanie do komórek śródbłonka, prowadząc do zakrzepicy [37]. Przeciwciała antyβ2GPI mogą ponadto wiązać się bezpośrednio z oksydowanymi cząsteczkami LDL, tworząc wysoce immunogenne kompleksy, stanowiące jeden z mechanizmów rozwoju zmian miażdżycowych u chorych z SLE [37]. Uwapnione zmiany miażdżycowe mogą tworzyć się także na podłożu mikrozakrzepów.