Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Ocena ryzyka powikłań zakrzepowych oparta na bezwzględnej różnicy agregacji płytek krwi budzi kontrowersje z uwagi na dużą międzyosobniczą zmienność wyjściowej agregacji (przed zastosowaniem inhibitora P2Y12). Ocena taka może prowadzić do przeszacowania ryzyka u osób nieodpowiadających na klopidogrel w przypadku wyjściowo niskiej reaktywności płytek krwi lub niedoszacowania w przypadku pacjentów z wyjściowo wysoką reaktywnością trombocytów, u których uzyskano znamienną redukcję reaktywności płytek krwi. Sugeruje się, że ocena reaktywności trombocytów podczas terapii (on-treatment platelet reactivity) ma przewagę nad bezwzględną różnicą agregacji.2
Aktualnie proponuje się pomiar rezydualnej reaktywności płytek podczas leczenia inhibitorem P2Y12 jako najlepszą metodę oceny odpowiedzi na leczenie.2 Wykazano przykładowo, że wysoka rezydualna reaktywność trombocytów podczas leczenia (HPR – high on-treatment platelet reactivity) klopidogrelem występuje u 60% pacjentów z zakrzepicą w stencie.2
Częstość HPR
Częstość HPR podczas terapii klopidogrelem ocenia się na 5-44%. W przypadku stosowania prazugrelu HPR występuje u 2-9% pacjentów, a tykagreloru – u ok. 1,5%.3 Choroby i czynniki o działaniu prozakrzepowym i prozapalnym (np. cukrzyca) mogą wpływać na częstość nieadekwatnej odpowiedzi na leki przeciwzakrzepowe. Także postać choroby niedokrwiennej serca może mieć znaczenie dla otrzymywanych wyników. HPR częściej obserwuje się u chorych z OZW niż u pacjentów ze stabilną dławicą piersiową.2
Zalecane metody oceny biologicznej funkcji trombocytów
W ostatniej dekadzie w pracach naukowych z zakresu leczenia przeciwzakrzepowego wykorzystywano rozmaite metody oceny czynności płytek krwi. Odmienna metodyka testów oceniających biologiczne funkcje trombocytów w różnych grupach badawczych, wynikająca m.in. z braku standaryzacji, progów odcięcia oraz ścisłej definicji badanych zjawisk, znacząco ograniczała powtarzalność wyników.
Obecnie stosowane metody oceny rezydualnej reaktywności płytek krwi (Multiplate Analyzer, VerifyNow, VASP-P) w dużej mierze przezwyciężyły opisane wyżej ograniczenia i na mocy konsensusu ekspertów z 2013 r. są zalecane do oceny odpowiedzi na leki przeciwpłytkowe.2 Na podstawie oceny danych z badań klinicznych w przywołanym konsensusie zaproponowano także wartości punktów odcięcia dla powyższych metod, uwzględniając zarówno dolne granice, poniżej których rośnie ryzyko zdarzeń krwotocznych, jak i górne granice – ryzyka zdarzeń niedokrwiennych.2
Zmienność odpowiedzi na leki przeciwpłytkowe
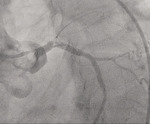
Rycina 2. Podostra zakrzepica w stentach u pacjentki z implantowanym stentem uwalniającym substancję antyproliferacyjną do pnia lewej tętnicy wieńcowej, gałęzi przedniej zstępującej i gałęzi okalającej lewej tętnicy wieńcowej 4 dni przed zdarzeniem
Zarówno wysoka, jak i niska rezydualna reaktywność trombocytów (LPR – low on-treatment platelet reactivity) podczas terapii przeciwzakrzepowej mogą się łączyć ze zwiększonym ryzykiem zdarzeń niepożądanych. Z uwagi na wieloletnie doświadczenie w stosowaniu klopidogrelu najwięcej doniesień literaturowych o związku reaktywności płytek krwi z wynikami klinicznymi leczenia dotyczy właśnie tego leku. Jak obecnie wiadomo, różnice osobnicze w reaktywności płytek krwi występują także podczas przyjmowania prazugrelu i tykagreloru.3 W porównaniu z klopidogrelem w przypadku tych leków częściej obserwuje się LPR, rzadziej zaś HPR. W metaanalizie 20 badań klinicznych Aradi i wsp. podają, że HPR podczas leczenia przeciwpłytkowego stanowi silny czynnik ryzyka zgonu, OZW i zakrzepicy w stencie.4 Zjawisko to jest niepokojące w przypadku pacjentów leczonych PCI. Wymagają oni bowiem terapii dwoma lekami przeciwpłytkowymi, aby osiągnąć akceptowalny, niski poziom ryzyka incydentów sercowo-naczyniowych, szczególnie ryzyka zakrzepicy w stencie (ryc. 2). Z drugiej strony uważa się, że zbyt silna blokada biologicznej funkcji trombocytów, pożądana z punktu widzenia redukcji powikłań niedokrwiennych, może zwiększać ryzyko krwawień, a tym samym nie polepszać wyników leczenia.2
HPR u pacjentów leczonych PCI
Na podstawie wielu doniesień, obejmujących łącznie ponad 20 tys. pacjentów, uważa się HPR za niezależny czynnik ryzyka epizodów niedokrwiennych u chorych leczonych za pomocą PCI.2 W prospektywnym wieloośrodkowym badaniu ADAPT-DES (Assessment of Dual Antiplatelet Therapy With Drug-Eluting Stents), do którego włączono ponad 8583 pacjentów, wykazano istotną zależność między HPR a zakrzepicą w stencie [iloraz szans (OR – odds ratio) 2,49; p = 0,001] oraz ponownym OZW (OR 1,42; p = 0,01). Jednocześnie u chorych z HPR znamiennie rzadziej występowały istotne krwawienia (OR 0,73; p = 0,002). Autorzy obserwowali związek HPR z częstością zdarzeń sercowo-naczyniowych w całej badanej grupie i u pacjentów z OZW. W badaniu nie wykazano zależności pomiędzy reaktywnością trombocytów a częstością zakrzepicy w stencie, zawału mięśnia sercowego czy istotnych klinicznie krwawień u pacjentów ze stabilną dławicą piersiową.5
W innym badaniu Ahn i wsp. oceniali związek między rezydualną reaktywnością trombocytów a rocznymi wynikami leczenia pacjentów poddanych PCI.6 Wykazali znamiennie wyższą rezydualną reaktywność płytek krwi u chorych, u których wystąpiły niepożądane zdarzenia sercowo-naczyniowe. Po stratyfikacji danych względem wskazań klinicznych do interwencji wieńcowej stwierdzono, że reaktywność płytek krwi nie miała istotnego znaczenia w przypadku pacjentów ze stabilną dławicą piersiową, podczas gdy u chorych z OZW i HPR istotnie częściej występowały zdarzenia niedokrwienne (p <0,002).6 Podobne wyniki uzyskali inni badacze: obserwowano, że u pacjentów leczonych interwencyjnie w przebiegu OZW, a nie elektywnie z powodu stabilnej choroby wieńcowej, HPR istotnie koreluje z częstością zdarzeń niepożądanych.
LPR u pacjentów leczonych PCI
Poważnym problemem u chorych leczonych przeciwpłytkowo są krwawienia. Sibbing i wsp. wykazali, że wśród pacjentów po PCI przyjmujących klopidogrel duże krwawienia występują znamiennie częściej u tych z LPR.7 Cuisset i wsp. notowali częstsze krwawienia u chorych z NSTEMI i LPR.8 Tsukahara i wsp. zaobserwowali, że wśród pacjentów poddanych PCI najlepsze wyniki leczenia osiągano u tych z wartością rezydualnej reaktywności trombocytów w zakresie drugiego i trzeciego kwartyla; chorzy z górnego kwartyla byli obarczeni zwiększonym ryzykiem powikłań niedokrwiennych, a chorzy z dolnego kwartyla – zwiększonym ryzykiem powikłań krwotocznych.9
Parodi i wsp. oceniali związek rezydualnej reaktywności trombocytów podczas terapii prazugrelem z częstością krwawień u 298 pacjentów leczonych za pomocą PCI (67% OZW). Kolejno: duże, małe i minimalne krwawienia wystąpiły u 2,7%, 4,7% i 15,1% pacjentów. Badacze wykazali, że LPR i płeć żeńska są niezależnymi czynnikami ryzyka epizodów krwotocznych (p = 0,001; p = 0,029).10
Rezydualna reaktywność płytek krwi – okno terapeutyczne
Obecnie rozważa się możliwość istnienia tzw. okna terapeutycznego, czyli optymalnego przedziału rezydualnej reaktywności płytek krwi z niskim ryzykiem epizodów niedokrwiennych i krwotocznych.2 We wspomnianym wyżej badaniu Sibbing i wsp. wykazali, że liczba epizodów niedokrwiennych i krwotocznych istotnie wzrasta po przekroczeniu pewnych granic.7 Wykres krzywej zależności wszystkich zdarzeń niepożądanych od reaktywności płytek krwi przyjął kształt litery „J”, z najmniejszą liczbą epizodów w przypadku pośrednich wartości reaktywności trombocytów (MPR – medium on-treatment platelet reactivity).7 W badaniu ARMYDA-PROVE (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty-Platelet Reactivity for Outcome Validation Effort) chorych podzielono na trzy grupy, przyjmując za podstawę wynik agregacji. Były to grupy: HPR, MPR i LPR. Częstość zdarzeń niepożądanych w grupie LPR wynosiła 14,1%, MPR – 7,8%, HPR – 15,4%. Częstość epizodów w grupie MPR była istotnie niższa niż w grupie HPR (p = 0,005) oraz LPR (p = 0,025).11