Wybrane czynniki prognostyczne w niewydolności serca
lek. Aneta Klotzka1
prof. dr hab. n. med. Ewa Straburzyńska-Migaj1,2
Złożone tło niewydolności serca przyczynia się do ciągłego poszukiwania markerów, które pozwolą szybciej ustalić rozpoznanie choroby i – co ważniejsze – dużo wcześniej rozpoznać zagrożenie dekompensacją. Markery te potrzebne są także do oceny stopnia zaawansowania tej jednostki chorobowej i optymalizacji terapii, w tym stosowania jej zaawansowanych form.
Wprowadzenie
Uważa się, że częstość występowania niewydolności serca (HF – heart failure) sięga obecnie rozmiarów epidemii. Spośród wszystkich nagłych przyjęć do szpitala ponad 5% stanowią pacjenci z HF. Częstość jej występowania zwiększa się wraz z wiekiem chorych, sięgając nawet 20% u pacjentów powyżej 70 roku życia.1
Pacjenci z niewydolnością serca bardzo często mają niespecyficzne objawy, które mogą prowadzić do opóźnienia ostatecznego rozpoznania. Z tego też powodu jego ustalenie tylko na podstawie objawów podmiotowych i przedmiotowych nadal pozostaje wyzwaniem. Wyniki badań pokazują, że tradycyjny, do niedawna obowiązujący schemat diagnozowania HF na podstawie badania podmiotowego, przedmiotowego i zdjęcia przeglądowego klatki piersiowej ma czułość wynoszącą 50-73% i specyficzność – 54-78%. W wytycznych European Society of Cardiology (ESC) podkreśla się, że dla rozpoznania HF – oprócz występowania typowych objawów podmiotowych, którym mogą towarzyszyć modelowe objawy przedmiotowe – konieczne jest potwierdzenie nieprawidłowej struktury i/lub czynności serca (najlepiej w badaniu echokardiograficznym). W algorytmie diagnostycznym wysokie miejsce zajmuje oznaczanie stężeń peptydów natriuretycznych.1 Coraz częstsze występowanie niewydolności serca skłania do poszukiwania coraz nowszych parametrów nieinwazyjnych, przybliżających rozpoznanie i służących ocenie stopnia zaawansowania oraz oszacowaniu rokowania w tej chorobie.
Aby uznać dany marker za przydatny klinicznie, powinny być spełnione wybrane warunki: marker taki musi być łatwy do oznaczenia w krótkim czasie wystandaryzowaną metodą, powinien dostarczać klinicznie istotnej informacji dotyczącej rozpoznania choroby lub oceny jej rokowania, być kompatybilny z innymi biomarkerami oraz wpływać na decyzje terapeutyczne i wspierać je w wymierny sposób. Markery oznaczane w niewydolności serca oprócz pozostawania istotnym narzędziem klinicznym mogą pozwalać na wyjaśnienie patofizjologicznych mechanizmów HF, a tym samym przyczyniać się do rozwoju nowych kierunków w leczeniu.
Dotychczas opisano ponad 100 parametrów, które zostały uznane za niezależne czynniki rokownicze w HF.2 Niewiele z nich ma jednak zastosowanie w codziennej praktyce klinicznej. Do tych o ugruntowanej pozycji należą peptydy natriuretyczne, troponiny, CA-125, ST2, żelazo, parametry badania echokardiograficznego: tempo narastania ciśnienia w lewej komorze (dP/dt) oraz doppler tkankowy (tissue Doppler).
Peptydy natriuretyczne
Peptydy natriuretyczne to rodzina genetycznie odmiennych peptydów, które są syntetyzowane i wydzielane przez kardiomiocyty w odpowiedzi na rosnące naprężenie ścian serca. Wzrost napięcia ścian może być spowodowany zarówno przeciążeniem objętościowym, jak i ciśnieniowym. W rezultacie obu tych procesów dochodzi do wydzielania przedsionkowego peptydu natriuretycznego (ANP) oraz peptydu natriuretycznego typu B (BNP). ANP jest bezpośrednio wydzielany z ziarnistości komórek mięśnia przedsionków niezwłocznie po zadziałaniu bodźca, ale peptyd ten ma krótki okres półtrwania – około 2 minut – co skutkuje bardzo dynamicznymi zmianami jego stężenia we krwi. Proces wydzielania BNP jest natomiast bardziej skomplikowany i kontrolowany na poziomie transkrypcji i aktywacji genów obecnych w kardiomiocytach, w efekcie czego dla wydzielania BNP konieczny jest dłuższy czas utrzymywania się bodźców w postaci rosnącego napięcia ścian. Krążące we krwi BNP utrzymują się około 10 razy dłużej niż ANP.2 Neurohormon ten powstaje jako preproBNP, z którego powstaje postać propeptydu proBNP, a ten ulega następnie rozszczepieniu na nieaktywny biologicznie 76-aminokwasowy koniec NT-proBNP oraz na BNP.
Nazwę „mózgowy” peptyd natriuretyczny zawdzięcza pierwszej identyfikacji z mózgu świń, chociaż u ludzi jest produkowany głównie przez komórki komór serca. Mimo że NT-proBNP i BNP są wytwarzane w proporcjach 1:1, stężenie NT-proBNP we krwi jest znacznie wyższe ze względu na jego dłuższy czas trwania. NT-proBNP w 55-65% jest usuwany przez nerki. Gdy przesączanie kłębuszkowe spada poniżej 30 ml/min/1,73 m2, stosunek stężeń NT-proBNP do BNP się zwiększa.
Hormony natriuretyczne jako aktywne biologicznie są odpowiedzialne za zmniejszenie wydzielania wazopresyny i hormonu kortykotropowego, nasilenie natriurezy i diurezy, hamowanie układu renina-angiotensyna-aldosteron, rozkurcz komórek mięśni gładkich i rozszerzenie naczyń.3
Zaobserwowano, że niektóre stany fizjologiczne, takie jak wzrastająca masa ciała oraz wiek, wpływają na stężenie obu tych substancji we krwi.4 U osób otyłych ich stężenie jest niższe, co może być konsekwencją zarówno zaburzonego wydzielania, jak i defektu receptorów w tkance tłuszczowej związanego z ich eliminacją. Wiek natomiast bezpośrednio koreluje z rosnącym stężeniem zarówno BNP, jak i proBNP. Na ich wartość ma wpływ także rasa. Osoby rasy białej mają ich niższe stężenie we krwi niż Afroamerykanie. Oba parametry mogą wzrastać także w innych stanach kardiologicznych związanych z przeciążeniem objętościowym lub ciśnieniowym mięśnia lewej komory, takich jak zatorowość płucna, nadciśnienie płucne, szybkie arytmie, istotne wady zastawkowe, amyloidoza. Zarówno stężenia NT-proBNP, jak i BNP mogą być podwyższone w innych jednostkach chorobowych niezwiązanych z chorobą serca, na przykład w przewlekłej niewydolności nerek, niedokrwistości, sepsie, udarze, oparzeniach. Obserwujemy podwyższanie się stężeń obu tych czynników w niewydolności serca, zarówno z obniżoną, jak i zachowaną frakcją wyrzutową. Z tego też powodu nie nadają się do rozróżniania obu typów niewydolności, chociaż wydaje się, że w przypadku HF z zachowaną frakcją wyrzutową ich stężenia we krwi są znacznie niższe.5,6
W wytycznych dotyczących niewydolności serca BNP/NT-proBNP mają ugruntowaną pozycję jako markery w rozpoznawaniu choroby. Ich wartości są różne dla pacjentów, u których objawy nastąpiły nagle, w porównaniu z tymi, u których rozwijały się stopniowo. U tych drugich za granicę przyjmuje się 125 pg/ml dla NT-proBNP oraz 35 pg/ml dla BNP. U pacjentów w stanie nagłym są to odpowiednio 300 pg/ml i 100 pg/ml.1
Oznaczanie BNP i proBNP pozostaje złotym standardem także w szacowaniu ryzyka zgonu z powodu HF oraz w monitorowaniu leczenia tej choroby. Obserwuje się spadek stężeń wspomnianych markerów po włączeniu terapii β-adrenolitykami, inhibitorami enzymu konwertującego oraz antagonistami aldosteronu, czyli lekami o udowodnionym działaniu przedłużającym długość życia w HF. Analogiczną sytuację zaobserwowano u pacjentów po wszczepieniu kardiowertera-defibrylatora z funkcją resynchronizującą. Odmiennie zachowują się stężenia peptydów u chorych leczonych nowym lekiem z grupy ARNI (angiotensin receptor neprilysin inhibitor) – sakubitrylem/walsartanem – wzrasta stężenie BNP (zgodnie z mechanizmem działania leku) i maleje NT-proBNP. Zaleca się, aby w ocenie skuteczności leczenia stosować oznaczanie stężenia NT-proBNP.
Troponiny
Troponiny sercowe są składową kompleksu troponinowo-tropomiozynowego w filamentach cienkich miofibryli mięśnia sercowego. W skład tego kompleksu wchodzi: troponina C, troponina I, troponina T oraz tropomiozyna. Ten konglomerat odpowiada za regulację skurczu mięśni. Troponiny nie występują pozakomórkowo, dlatego ich wzrost w macierzy pozakomórkowej jest swoistym i czułym parametrem uszkodzenia kardiomiocytów. Fizjologicznie prawidłowe stężenia troponin są bliskie zeru. Aby poprawnie odczytać i zinterpretować wynik ich oznaczenia w surowicy, trzeba dysponować informacją na temat stosowanej metody oznaczenia oraz jej wartości odcięcia.
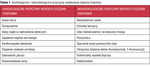
Troponiny sercowe są szeroko rozpowszechnione jako marker służący diagnostyce choroby niedokrwiennej serca. Jest jednak wiele innych jednostek chorobowych i sytuacji, w których stężenie troponin wzrasta. Należą do nich: zatorowość płucna, zapalenie mięśnia sercowego, sepsa, arytmie, stosowanie leków kardiotoksycznych, przewlekła niewydolność nerek (tab. 1).7
W 1997 roku Missov po raz pierwszy zauważył wzrost stężenia troponin u pacjentów z niewydolnością serca, bez związku z jego niedokrwieniem. Mechanizm wzrostu ich stężeń w ostrej i przewlekłej niewydolności serca jest złożony i obejmuje: niedokrwienie endokardium (typ I i II zawału mięśnia sercowego), uszkodzenie kardiomiocytów spowodowane cytokinami zapalnymi, stres oksydacyjny czy apoptozę. Zauważono, że u pacjentów z dekompensacją HF wzrost stężenia wysokoczułej troponiny I jest bardzo częstym zjawiskiem. Występuje on także u pacjentów ze stabilną niewydolnością serca.