Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
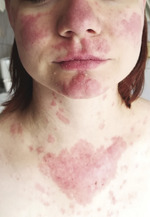
Rycina 1. Przykurcze stawów międzypaliczkowych (nienadżerkowa artropatia typu Jaccouda) w przebiegu mieszanej choroby tkanki łącznej i tocznia rumieniowatego układowego
W ustaleniu rozpoznania pomocne są kryteria klasyfikacyjne twardziny układowej ustalone przez American College of Rheumatology i European League Against Rheumatism (ACR/EULAR) 2013, obejmujące oprócz zmian skórnych także ocenę zajęcia narządowego: tętnicze nadciśnienie płucne i/lub śródmiąższową chorobę płuc, objaw Raynauda i zaburzenia serologiczne, tj. obecność charakterystycznych dla TU autoprzeciwciał, takich jak przeciwko topoizomerazie I (Scl-70), antycentromerowych (ACA) czy przeciwjąderkowych3. Drugą co do częstości zmianą narządową jest choroba śródmiąższowa płuc.
Nadciśnienie płucne w twardzinie układowej rozwija się najczęściej wskutek waskulopatii (tętnicze nadciśnienie płucne – grupa 1 NP). Obliteracyjna angiopatia małych i średnich tętnic płucnych – wyrażająca się znacznym pogrubieniem ścian naczyń – prowadzi do następczego wzrostu oporów i ciśnienia w krążeniu małym. Nadciśnienie płucne w przebiegu twardziny może być również wtórne do choroby śródmiąższowej płuc, a także być skutkiem dysfunkcji, głównie rozkurczowej, lewej komory serca. Należy też pamiętać, że poza zmianami histopatologicznymi analogicznymi do obserwowanych w idiopatycznym tętniczym nadciśnieniu płucnym częściej niż w innych postaciach TNP dochodzi do zajęcia drobnych naczyń żylnych, mogącego dawać obraz choroby zarostowej żył płucnych. Szacuje się, że u 8-19% chorych z TU dochodzi do rozwoju TNP. W 2014 r. opublikowano wyniki badania DETECT, którego celem było stworzenie algorytmu umożliwiającego wczesne wykrycie TNP u pacjentów z twardziną układową3. W badaniu tym brały udział 62 ośrodki zajmujące się leczeniem twardziny układowej z Europy, Azji i Ameryki Północnej. Badaną grupę stanowili chorzy z ustalonym rozpoznaniem TU, u których czas trwania choroby wynosił >3 lata, a wartość uzyskana w badaniu pojemności dyfuzyjnej płuc dla tlenku węgla (DLCO – diffusion lung capacity for carbon monoxide) <60%. W tej grupie chorych przeprowadzono szereg badań diagnostycznych nieinwazyjnych, a następnie u wszystkich (bez względu na uzyskane wyniki i objawy kliniczne) przeprowadzono cewnikowanie prawej części serca. Wykonanie tej procedury u 466 chorych pozwoliło na rozpoznanie TNP u 87 z nich, co stanowiło 19% badanych. Wśród nich u 70% rozpoznano postać ograniczoną twardziny układowej, natomiast u 20% – postać uogólnioną. W innym dużym badaniu prowadzonym w Czechach i we Włoszech częstość występowania TNP w twardzinie układowej wynosiła odpowiednio 7,08% i 3,7%3. Nadciśnienie płucne wtórne do choroby śródmiąższowej płuc (grupa 3 NP) notowano rzadziej (około 1%), podobnie jak postać wtórną do niewydolności lewej komory serca (grupa 2 NP; też ok. 1%).
Do głównych czynników rozwoju nadciśnienia płucnego w twardzinie układowej zalicza się: zaawansowany wiek chorego, okres po menopauzie u kobiet, znaczny stopień zajęcia skóry, ciężką waskulopatię obwodową, włóknienie płuc, mikrostomię, refluks żołądkowo-przełykowy i dysfagię4. Dodatkowym czynnikiem ryzyka wystąpienia nadciśnienia płucnego jest obecność teleangiektazji i nieprawidłowego obrazu naczyń wału paznokciowego w kapilaroskopii. Istotnym czynnikiem prognostycznym jest również znaczące obniżenie współczynnika transferu płucnego dla tlenku węgla (TLCO). Uważa się, że obniżenie wartości TLCO <52% wyprzedza rozwój nadciśnienia płucnego przeciętnie o 4,5 roku. Dodatkowo stwierdzono, że wartość wskaźnika DLCO/VA <70% wraz ze wzrostem stężenia peptydu natriuretycznego NT-proBNP w dużym stopniu koreluje z rozwojem nadciśnienia płucnego.
Nadciśnienie płucne jest przyczyną 30% zgonów wśród chorych na twardzinę układową, co sprawia, że jest ono wiodącym czynnikiem śmiertelności. Tętnicze nadciśnienie płucne i choroba śródmiąższowa płuc razem odpowiadają za 70% zgonów wśród chorych. Uważa się, że w ostatnich dekadach częstość zgonów z powodu NP relatywnie wzrosła wskutek redukcji śmiertelności z powodu twardzinowego przełomu nerkowego.
W obrazie klinicznym NP spotyka się duszność wysiłkową i ograniczenie wydolności fizycznej. Objawy te nie są specyficzne, mogą też w początkowym okresie choroby ujść uwadze chorego i lekarza, zwłaszcza jeśli inne powikłania TU, takie jak dolegliwości ze strony układu ruchu, ograniczają wydolność fizyczną pacjenta i utrudniają wykonywanie większych wysiłków. Chorzy mogą zgłaszać ból w klatce piersiowej i/lub omdlenia. W zaawansowanym stadium choroby dochodzi do rozwoju niewydolności prawokomorowej. W badaniu przedmiotowym uwagę powinny zwrócić: skurczowy szmer niedomykalności zastawki trójdzielnej, akcentacja drugiego tonu nad tętnicą płucną, prawokomorowy trzeci ton serca i objawy prawokomorowej niewydolności serca, tj. zastoju krwi w naczyniach żylnych.
Jak wspomniano wcześniej, główną przyczyną rozwoju NP jest angiopatia dotycząca małych i średnich naczyń krwionośnych. Zjawisko to dotyczy również skóry, klinicznie może objawiać się pod postacią teleangiektazji, czyli poszerzeń naczyń krwionośnych, i nieprawidłowości naczyń wału paznokciowego w badaniu kapilaroskopowym. Charakterystyczne dla późnego okresu twardziny (choć niepatognomoniczne) są megakapilary (częściej w postaci ograniczonej twardziny układowej) i obszary pozbawione naczyń (dominują w uogólnionej TU). Na obraz kliniczny zmian naczyniowych składa się również objaw Raynauda, występujący u blisko 100% chorych na postać ograniczoną twardziny układowej i u 90% z postacią uogólnioną. Charakteryzują go trzy fazy: zblednięcia, zasinienia i czynnego przekrwienia palców z uczuciem ich mrowienia; część chorych skarży się na napadowe sinienie kończyn i ból palców. Wystąpieniu objawu Raynauda sprzyjają ekspozycja na niską temperaturę otoczenia i stres emocjonalny. Zmiany mogą dotyczyć też koniuszka nosa, uszu i bardzo rzadko brodawek sutkowych. W wyniku waskulopatii może dojść do powstania owrzodzeń skórnych i martwicy opuszek palców.
Bardzo istotnym zagadnieniem jest właściwy skrining TNP wśród chorych na twardzinę układową. Uważa się, że może on odpowiadać za istotnie wyższe 3-, 5- i 8-letnie przeżycie w grupie aktywnie obserwowanej i leczonej w porównaniu z grupą pacjentów z objawami, u których wdrożono leczenie po wystąpieniu nadciśnienia płucnego3. Według aktualnych wytycznych ESC/ERS wszyscy pacjenci bez objawów z twardziną układową i chorobami tkanki łącznej z grupy ryzyka rozwoju twardziny (spektrum chorób twardzinopodobnych) powinni być monitorowani pod kątem rozwoju nadciśnienia płucnego. Do zalecanych badań należą: echokardiografia przezklatkowa, DLCO i oznaczenie NT-proBNP na początkowym etapie choroby. Uważa się, że badanie echokardiograficzne serca i badania czynnościowe płuc powinny być powtarzane rokrocznie. Gremia naukowe uczestniczące w Fifth World Symposium on Pulmonary Hypertension zalecają dwustopniowy monitoring chorych na twardzinę układową bez objawów. W pierwszej kolejności poleca się wnikliwe badanie przedmiotowe z oceną występowania teleangiektazji na skórze, wykonanie badań laboratoryjnych z oznaczeniem przeciwciał antycentromerowych (ACA), stężenia kwasu moczowego, wartości NT-proBNP, EKG i badań czynnościowych płuc z oceną zdolności dyfuzji gazów w płucach3. W drugiej kolejności powinno się wykonać echokardiografię przezklatkową i rozważyć cewnikowanie prawej komory serca. Na podstawie analizy statystycznej wyników uzyskanych w badaniu DETECT opracowano algorytm diagnostyki TNP w twardzinie układowej, dostępny online (https://detect-pah.com/pah-risk-calculator/calculator-step-1). W pierwszym etapie ocena ryzyka występowania TNP dokonywana jest na podstawie danych klinicznych, tj. wyników badań czynnościowych płuc (wskaźnik FVC/DLCO), wartości NT-proBNP, występowania teleangiektazji, obecności przeciwciał antycentromerowych, wyników prawogramu w EKG serca. Dla każdej zmiennej przypisano wartość punktową, która odczytywana jest z opracowanych wykresów, tzw. nomogramów. Jeżeli suma punktów przekracza 300, należy przejść do drugiego stopnia algorytmu6. W drugim etapie należy wykonać badanie echokardiograficzne serca. W przypadku stwierdzenia nieprawidłowości w badaniu należy – podobnie jak we wcześniejszym etapie – ocenić punktację, która jest sumą punktów odczytanych z normogramów na podstawie wartości powierzchni prawego przedsionka i fali zwrotnej na zastawce trójdzielnej oraz odpowiedniej wartości dla punktacji uzyskanej w pierwszym etapie. Inwazyjne badanie cewnikowania prawej części serca według algorytmu wykonywane jest wyłącznie u chorych, którzy uzyskają punktację ≥35 w ocenie ryzyka. Algorytm DETECT nie jest zalecany w monitorowaniu pacjentów z DLCO >60%.
W reumatologicznych rekomendacjach dotyczących leczenia twardziny układowej podkreśla się, że terapię należy prowadzić według rekomendacji opracowanych przez europejskie towarzystwa kardiologiczne i pulmonologiczne.
Zasady leczenia swoistego tętniczego nadciśnienia płucnego w przebiegu twardziny układowej nie różnią się istotnie od zasad terapii w innych postaciach TNP. Wyróżnia się trzy grupy leków doustnych: antagonistów endoteliny, selektywne inhibitory fosfodiesterazy typu 5, antagonistów prostacykliny i riocyguat. Mniejszą skuteczność farmakoterapii tłumaczy się z jednej strony różnego stopnia zajęciem płucnych naczyń żylnych, z drugiej – współistniejącymi zmianami w tkance śródmiąższowej płuc i pozapłucnymi powikłaniami narządowymi. Ze względu na postępujący przebieg choroby leczenie TNP może wymagać agresywniejszej terapii. W przypadku wtórnych postaci nadciśnienia płucnego zaleca się leczenie przyczyny pierwotnej (np. śródmiąższowej choroby płuc, niewydolności lewokomorowej) i postępowanie objawowe.
Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy jest drugą najczęstszą chorobą tkanki łącznej, w przebiegu której dochodzi do rozwoju nadciśnienia płucnego. Jest to wielonarządowy, przewlekły zespół chorobowy o podłożu autoimmunizacyjnym i autozapalnym, charakteryzujący się różnorodnymi objawami klinicznymi wynikającymi ze stanu zapalnego. W TRU dochodzi do zaburzeń układu immunologicznego wskutek upośledzonej funkcji limfocytów B i T oraz nieprawidłowego usuwania komórek apoptotycznych i kompleksów immunologicznych, co prowadzi do uwalniania autoantygenów, a w efekcie warunkuje autoimmunizację i powstawanie specyficznych autoprzeciwciał. Jednocześnie dochodzi do zaburzeń odpowiedzi wrodzonej układu odpornościowego (autozapalenie). Oba patomechanizmy wywołują nadmierną reakcję zapalną (efekt cytotoksyczny, tworzenie kompleksów immunologicznych), powstawanie nacieków zapalnych tkanki łącznej, naczyń krwionośnych w różnych narządach, prowadząc do ich niewydolności5.
Częstość występowania TRU szacuje się na 25-50/100 000 osób, z roczną zachorowalnością wynoszącą 3-5/100 0001. Choroba dotyczy częściej kobiet, zwłaszcza w wieku rozrodczym, jest też znamiennie częstsza w populacji Afroamerykanów i Azjatów. Obraz kliniczny choroby może być bardzo zróżnicowany – od stosunkowo łagodnie przebiegających postaci po stan bezpośredniego zagrożenia życia. W przebiegu TRU występują okresy zaostrzeń i wieloletnie okresy remisji. W obrazie klinicznym choroby występują zarówno objawy ogólne, jak i miejscowe. Podobnie jak w innych jednostkach reumatologicznych w badaniu podmiotowym należy spodziewać się uczucia osłabienia z łatwą męczliwością, nieintencjonalnej utraty masy ciała i gorączki i/lub stanów podgorączkowych. Bardzo częstym objawem ostrej skórnej postaci tocznia rumieniowatego jest zajęcie skóry i błon śluzowych (85%). Typową zmianą jest rumień na twarzy w kształcie motyla, który pojawia się po ekspozycji na światło słoneczne (promieniowanie UVB). W postaci ograniczonej ostrego skórnego tocznia rumieniowatego układowego zmiany są obecne wyłącznie na twarzy i obejmują policzki, grzbiet nosa, niekiedy również czoło, okolice oczu i szyję z dekoltem. W postaci układowej dochodzi do wystąpienia zmian także na innych eksponowanych na światło słoneczne częściach ciała. Zmiany mogą mieć różną morfologię – od rumienia po zmiany plamisto-grudkowe, pęcherzowe lub przypominające toksyczną nekrolizę naskórka. Rzadszą postacią TRU jest postać podostra i przewlekła, tzw. toczeń krążkowy.
W badaniu przedmiotowym należy dokładnie ocenić błony śluzowe jamy ustnej, gdzie w aktywnej fazie choroby spotyka się nadżerki. Trzeba również poszukiwać opisywanego już wcześniej objawu Raynauda, łysienia bez cech bliznowacenia, erytromelalgii, rumienia dłoniowego. W przebiegu TRU dochodzi do rozwoju zmian wielonarządowych. Zajęcie narządu ruchu przyjmuje najczęściej postać bólu stawów i/lub mięśni czy – rzadziej – niedestrukcyjnego zapalenia stawów. U około połowy chorych odkładanie kompleksów immunologicznych prowadzi do rozwoju nefropatii toczniowej w postaci przewlekłego kłębuszkowego zapalenia nerek, rzadziej – gwałtownie postępującego kłębuszkowego zapalenia nerek, śródmiąższowego zapalenia nerek czy kwasicy cewkowej dalszej. W badaniach laboratoryjnych należy spodziewać się białka w moczu, nierzadko białkomoczu nerczycowego, obniżenia wskaźnika przesączania kłębuszkowego (GFR – glomerular filtration rate) czy hiperkaliemii. Należy zwrócić też uwagę na zmiany w układzie nerwowym. W diagnostyce różnicowej zaburzeń psychicznych czy neurologicznych bez innej uchwytnej przyczyny należy wziąć pod uwagę TRU. W przebiegu choroby może dojść także do zajęcia układu krążenia, najczęściej pod postacią wysiękowego zapalenia osierdzia.
W diagnostyce i monitorowaniu chorych niezbędne jest badanie echokardiograficzne serca, które pozwala wykryć wady zastawkowe czy cechy zapalenia wsierdzia. Toczeń rumieniowaty układowy predysponuje też do rozwoju miażdżycy i choroby niedokrwiennej serca. Zajęcie układu oddechowego może przybierać różnorodny obraz kliniczny – od rozwoju śródmiąższowego zapalenia płuc, przez wysiękowe zapalenie płuc, po nadciśnienie płucne.
Przed rozpoznaniem TRU należy przeprowadzić diagnostykę różnicową obejmującą przede wszystkim zakażenia (sepsa, zapalenie wsierdzia, zakażenia wirusowe, np. zakażenie HIV), choroby nowotworowe (białaczki, chłoniaki), inne choroby układowe tkanki łącznej, reakcje toksyczne. W przypadku zespołu nerczycowego/nefrytycznego lub postępującej niewydolności nerek w przebiegu TRU należy wykonać biopsję nerki; wynik badania histopatologicznego determinuje wybór leczenia.
W rozpoznaniu choroby pomocne mogą być kryteria klasyfikacyjne TRU, do których zalicza się wyżej wymienione objawy kliniczne i odchylenia w badaniach laboratoryjnych. Mogą występować zaburzenia hematologiczne: leukopenia z limfopenią, małopłytkowość, niedokrwistość hemolityczna i zaburzenia immunologiczne, takie jak nieprawidłowe miano przeciwciał przeciwjądrowych (ANA >1:80), przeciwciała anty-dsDNA, anty-Sm, antyfosfolipidowe, fałszywie dodatnie serologiczne odczyny kiłowe (VDRL), obniżone stężenie składowych układu dopełniacza (C3, C4, CH50), dodatni wynik testu Coombsa. Rodzaj przeciwciał może korelować z określoną postacią kliniczną. Obecność ANA bez objawów klinicznych nie upoważnia do rozpoznania TRU, ponieważ mogą one występować w innych stanach chorobowych i u osób zdrowych. Z drugiej strony nie rozpoznaje się TRU, jeżeli chory nie spełnia żadnego z kryteriów immunologicznych. W przebiegu TRU zazwyczaj zwiększona jest wartość OB, stężenie CRP jest na ogół prawidłowe. Mogą występować: zwiększenie aktywności aminotransferaz, wydłużenie APTT (co może sugerować współistniejący zespół antyfosfolipidowy), hiperferrytynemia (co świadczy o ryzyku zespołu aktywacji makrofagów).
Etiologia rozwoju nadciśnienia płucnego w tej chorobie jest również wieloczynnikowa. Za najczęstszą przyczynę uważa się postępującą przebudowę tętniczek z proliferacją komórek śródbłonka i komórek mięśni gładkich. U podłoża zmian leży uszkodzenie śródbłonka wskutek czynników immunologicznych, mechanicznych lub biochemicznych. Waskulopatia i wzrost oporu płucnego są podobne do występujących w tętniczym nadciśnieniu płucnym obserwowanym w twardzinie układowej. Do rozwoju nadciśnienia płucnego predysponuje obecność przeciwciał anty-RNP. Wśród pacjentów z TRU, u których dochodzi do rozwoju TNP, częściej też występuje objaw Raynauda. Szacuje się, że w populacji chorych na TRU 20-25% osób ma objaw Raynauda, podczas gdy u osób, u których ustalono rozpoznanie TRU i wtórnego TNP, ta częstość wzrasta aż do 62-80%. Wskazuje to na wspólny mechanizm wazokonstrykcji naczyń i istotny udział podwyższonego stężenia działającej kurcząco na naczynia endoteliny 1. Rozwój nadciśnienia płucnego może wynikać też ze współistniejącego z TRU zespołu antyfosfolipidowego i obecności w osoczu przeciwciał antyfosfolipidowych (antykoagulant toczniowy, przeciwciała antykardiolipinowe, przeciwciała przeciwko β2-glikoproteinie 1). Mechanizm powstania TNP jest tu niejasny. Z jednej strony może ono być efektem mikrozatorowości płucnej wynikającej z predyspozycji do zakrzepicy7, z drugiej – wydaje się, że krążące we krwi przeciwciała antyfosfolipidowe mogą oddziaływać na śródbłonek, zmniejszając produkcję prostacyklin i/lub działając stymulująco na produkcję endoteliny 1. Najrzadszą przyczyną rozwoju nadciśnienia płucnego wydaje się waskulopatia wynikająca z zapalenia naczyń. Nie można zapominać również o rozwoju nadciśnienia płucnego wtórnie do choroby śródmiąższowej płuc, będącej jednym z objawów narządowych TRU. Podkreśla się rolę monitorowania chorych pod kątem rozwoju TNP, jak wskazują badania, ujawnia się ono bowiem zwykle w ciągu 5 lat od zachorowania. W leczeniu nadciśnienia płucnego stosuje się terapię naczynioaktywną i celowaną agresywną terapię immunosupresyjną. Mimo że wciąż brakuje jednoznacznych zaleceń, uważa się, że terapia kombinowana może poprawić rokowanie w tej grupie chorych.