Sympozjum: medycyna tropikalna
Leiszmanioza
Elinor M. Moore,1 Diana N. Lockwood2
Szacuje się, że na całym świecie co roku dochodzi do 1,5-2 mln zachorowań na leiszmaniozę trzewną lub skórną, a 70 tys. osób umiera z jej powodu.1 Świdrowce z rodzaju Leishmania wnikają do organizmu człowieka po ukąszeniu muchówki (moskita) z rodzaju Phlebotomus. W Wielkiej Brytanii z leiszmaniozą można się spotkać rzadko, dlatego doświadczenie większości lekarzy brytyjskich w rozpoznawaniu i leczeniu tej choroby jest niewielkie. W 2005 r. w Anglii, Walii i Irlandii Północnej opisano zaledwie 58 przypadków tej choroby.2 Autorki przedstawiają dwa główne typy kliniczne leiszmaniozy, skupiając się na obrazie klinicznym, z jakim mają do czynienia lekarze w Wielkiej Brytanii.
Leiszmanioza trzewna
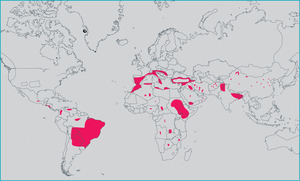
Leiszmanioza trzewna (VL – visceral leishmaniasis) najczęściej występuje w Indiach i w Sudanie (ryc. 1), ale wielu Brytyjczyków przywleka leiszmaniozę z krajów basenu Morza Śródziemnego, czasem nawet po krótkotrwałej ekspozycji w trakcie wyjazdu wakacyjnego.
Okres inkubacji, od ukąszenia przez muchówkę do ujawnienia się choroby, trwa zwykle kilka miesięcy, a czasem nawet dłużej.
Ramka 1. Opis przypadku leiszmaniozy trzewnej
61-letni mężczyzna zgłosił się do szpitala rejonowego z powodu gorączki, złego samopoczucia, jadłowstrętu i utraty masy ciała. Z uwagi na bardzo wysokie stężenie ferrytyny oraz łagodną pancytopenię z reaktywnością szpiku kostnego rozpoznano u niego chorobę Stilla u dorosłych. Rozpoczęto leczenie prednizolonem i azatiopryną, co spowodowało pewne złagodzenie objawów. Mężczyzna zgłosił się jednak ponownie po ośmiu miesiącach z powodu nasilenia dolegliwości. Stwierdzono splenomegalię i powiększenie węzłów chłonnych, a także pogłębienie pancytopenii (Hb 7,9 g/l, leukocyty 0,6 × 103/μl, płytki krwi 106 × 103/μl). W drugiej z pobranych próbek szpiku kostnego wykryto amastygoty Leishmania sp. W ciągu ostatnich 2 lat pacjent wyjeżdżał na krótkotrwałe pobyty do Egiptu, Turcji i Hiszpanii. Ostatnio rozpoznano u niego cukrzycę typu 2, nie stwierdzono natomiast zakażenia HIV. Jego wyniki badań serologicznych w kierunku zarażenia Leishmania sp. (DAT i RK39) były dodatnie. Pacjenta leczono, podając standardowy kurs amfoterycyny B w postaci liposomalnej, ale przed przyjęciem ostatniej dawki leku doszło do ostrej niewydolności nerek ze zwiększeniem stężenia kreatyniny do 730 μmol/l (8,3 mg/dl). W badaniu bioptatu nerki wykryto cewkowo-śródmiąższowe zapalenie nerek z obecnością limfocytów i eozynofilów, uznane za wtórne do leczenia liposomalną amfoterycyną B. Zastosowano krótkotrwałe leczenie prednizolonem, po którym zaburzenia czynności nerek szybko ustąpiły, nie obserwowano też nawrotu leiszmaniozy trzewnej. Stan pacjenta pozostaje dobry.
Obraz kliniczny
U chorych na leiszmaniozę trzewną występuje przewlekła gorączka, splenomegalia i pancytopenia (ramka 1). Zwykle obserwuje się utratę masy ciała, a niekiedy również następstwa pancytopenii (krwawienie, głęboką niedokrwistość i współistniejące zakażenie). Podczas badania przedmiotowego stwierdza się powiększenie wątroby i węzłów chłonnych. Inne nieprawidłowości to hipoalbuminemia i hipergammaglobulinemia poliklonalna (może być przyczyną fałszywie dodatnich wyników oznaczenia autoprzeciwciał).
Kluczowe zagadnienia
- Leiszmaniozę trzewną należy podejrzewać u chorych z przewlekłą gorączką, pancytopenią i splenomegalią.
- Leiszmaniozę skórną należy podejrzewać u chorych z przewlekłymi owrzodzeniami skórnymi na odsłoniętych obszarach ciała.
- Należy pytać chorych o przebyte podróże, w tym pobyty w krajach basenu Morza Śródziemnego.
- Upośledzenie odporności zmienia obraz kliniczny leiszmaniozy, a co za tym idzie także sposób postępowania z chorymi.
- Leiszmanioza w Wielkiej Brytanii występuje rzadko, ale w razie podejrzenia tej choroby dostępna jest pomoc ekspertów.
Rozpoznawanie
Rozpoznanie leiszmaniozy trzewnej ustala się na podstawie wykrycia pasożytów w preparacie pod mikroskopem lub w hodowli. Najlepiej badać materiał uzyskany z biopsji szpiku kostnego, choć w ośrodkach specjalistycznych ocenia się materiał pobrany drogą biopsji aspiracyjnej śledziony, ponieważ dostarcza on dodatkowych informacji o stopniu infestacji. Przeprowadzenie biopsji śledziony wymaga doświadczenia z uwagi na ryzyko wystąpienia krwawienia. W specjalistycznych laboratoriach parazytologicznych można również przeprowadzić badanie materiału pochodzącego od chorego metodą łańcuchowej reakcji polimerazy (PCR – polymerase chain reaction) w celu wykrycia DNA pierwotniaka. Dostępne są także dwa testy serologiczne pozwalające na wykrycie przeciwciał przeciw Leishmania spp.:
- test bezpośredniej aglutynacji (DAT – direct agglutination test): jest to półilościowy test aglutynacyjny, do którego wykorzystuje się zabite pierwotniaki z rodzaju Leishmania (antygeny) i krew albo surowicę badanego pacjenta w coraz większych rozcieńczeniach (czułość 92,7-96,4%)
- test paskowy RK39: test jakościowy z użyciem rekombinowanego antygenu występującego u pierwotniaka z rodzaju Leishmania, do którego wykorzystuje się krew pacjenta (czułość 87,7-97,1%).3
Interpretacja wyników tych testów wymaga doświadczenia. Wyniki są dodatnie mimo zastosowania właściwego leczenia w leiszmaniozie trzewnej, nie można ich zatem wykorzystywać do oceny wyników leczenia pierwotnej choroby ani nawrotu. Na obszarach endemicznych swoistość testów może być niewielka, ponieważ w populacji osób eksponowanych na tego pierwotniaka, u których jednak nie doszło do rozwoju choroby, stwierdza się niekiedy odpowiedź immunologiczną polegającą na wytworzeniu przeciwciał (w niektórych regionach nawet u 32% populacji). U niemal połowy osób zakażonych HIV badania serologiczne dają wyniki fałszywie ujemne.4
Leczenie
W Wielkiej Brytanii w leczeniu pierwszego rzutu chorych na leiszmaniozę trzewną wykorzystuje się amfoterycynę B w postaci liposomalnej. Stosowany obecnie schemat terapii polega na podaniu łącznie 20 mg/kg leku w pięciu dawkach w ciągu 10 dni (tj. 4 mg/kg/24 h w dniach 1., 2., 3., 5. i 10.). Takie postępowanie zapewnia wyleczenie u 95% chorych.5 W badaniach przeprowadzonych w Indiach uzyskiwano 90% wyleczeń po podaniu pojedynczej dawki liposomalnej amfoterycyny B.6 Do działań niepożądanych należą: upośledzenie czynności nerek, hipokaliemia, odczyny w miejscu podania leku oraz niedokrwistość.
W innych częściach świata wciąż powszechnie wykorzystuje się inne leki, tańsze i prostsze w użyciu, takie jak antymonoglukonian sodu (SSG – sodium stibogluconate).7 Zaproponowano również leczenie skojarzone, by uniknąć rozwoju oporności pasożyta na leki, którą obserwowano u chorych w Indiach.8
W tabeli zestawiono leki stosowane u chorych na leiszmaniozę trzewną, w tym leki wykorzystywane w Wielkiej Brytanii u osób, które nie tolerują liposomalnej amfoterycyny B lub jest ona u nich mało skuteczna.9
|
Tabela. Leki stosowane w leiszmaniozie trzewnej |
||||||
|
Lek |
Koszt* |
Czas trwania leczenia (dni) |
Droga podania |
Skuteczność (%)** |
Działania niepożądane |
Obszar stosowania |
|
Liposomalna amfoterycyna B |
£££ |
10 |
i.v. |
95 |
Upośledzenie czynności nerek Hipokaliemia Niedokrwistość |
Europa |
|
Amfoterycyna B |
££ |
30 |
i.v. |
95 |
Jak wyżej, częstsze jednak odczyny w miejscu podania wlewu |
Indie |
|
Antymonoglukonian sodu |
££ |
28 |
i.m. i.v. |
95 |
Zaburzenia gastryczne Bóle mięśni Zaburzenia przewodzenia sercowego Zwiększona aktywność aminotransferaz (transaminitis) Zwiększona aktywność amylazy w surowicy |
Afryka Brazylia |
|
Miltefozyna |
Wielka Brytania: £££ Indie: £ |
28 |
Doustnie |
94 |
Zaburzenia przewodu pokarmowego Toksyczność wobec układu rozrodczego |
Indie |
|
Paromomycyna |
£ |
21 |
i.m. |
94,6 |
Zwiększona aktywność aminotransferaz (transaminitis) Ból w miejscu wstrzyknięcia Ototoksyczność |
Indie |
* Przybliżony koszt całego kursu leczenia osoby dorosłej.
** Odsetek wyleczeń po leczeniu wstępnym chorych niezakażonych HIV.