Sympozjum: zaburzenia rytmu
Współczesne stymulatory: co powinien wiedzieć lekarz podstawowej opieki zdrowotnej?
Karoly Kaszala1, MD, PhD
José F. Huizar1, MD
Kenneth A. Ellenbogen1,2, MD
W SKRÓCIE
Stymulację najczęściej stosuje się z powodu objawowej bradykardii wynikającej zwykle z choroby węzła zatokowego. Wieloośrodkowe próby kliniczne przeprowadzone z randomizacją, w których oceniano względne korzyści ze stosowania różnych trybów stymulacji, umożliwiły oparte na dowodach z badań naukowych podejście do leczenia bradyarytmii. Znaczny postęp w zakresie technologii i rozumienia patofizjologii serca w ciągu kilku ostatnich dziesięcioleci doprowadził do opracowania nowych technik stymulacji wykorzystywanych w leczeniu niewydolności serca u pacjentów, u których nie występuje bradykardia. Stymulacja lewej komory lub dwukomorowa może zmniejszać objawy niewydolności serca i poprawiać obiektywne wskaźniki dysfunkcji skurczowej lewej komory poprzez resynchronizację skurczu serca. Nowe dane kliniczne wskazują jednak, że długotrwała stymulacja wierzchołka prawej komory może mieć szkodliwe następstwa. Złożoność urządzeń do stymulacji serca stale się zwiększa, dlatego lekarze muszą posiąść podstawową wiedzę na temat wskazań do stymulacji, funkcjonowania tych urządzeń, a także częstych problemów spotykanych u pacjentów ze stymulatorami zarówno w warunkach klinicznych, jak i domowych.
Stymulacja stanowi podstawę leczenia objawowych bradyarytmii już od 50 lat.1 Stymulatory zastosowano najpierw u pacjentów z całkowitym blokiem przedsionkowo-komorowym po operacjach oraz u chorych z napadami Morgagniego-Adamsa-Stokesa.2 Istotny postęp technologiczny, który dokonał się w tej dziedzinie w ciągu ostatnich pięciu dekad, następował równolegle z lepszym rozumieniem zaburzeń rytmu serca i patofizjologii serca. Dzięki wynikom nowszych badań dotyczących podstaw hemodynamiki serca opracowano stymulację dwujamową z czuwaniem i hamowaniem oraz śledzeniem aktywności w kanale przedsionkowym (DDD), stymulację ze zmienną (adaptowaną) częstością oraz stymulację dwukomorową. Postępy w elektronice i miniaturyzacji umożliwiły wykładniczy wzrost liczby parametrów stymulatora, które można programować, a także ilości danych zbieranych i gromadzonych przez te urządzenia. Mimo że objawowy blok przedsionkowo-komorowy i choroba węzła zatokowego pozostają najczęstszymi przyczynami wszczepiania stymulatora, nastąpił też szybki rozwój wiedzy na temat innych, nowszych wskazań do stymulacji. Głównymi celami leczenia za pomocą stymulatorów są redukcja objawów klinicznych oraz poprawa jakości życia i stanu czynnościowego pacjentów. Tylko w Stanach Zjednoczonych wszczepia się ponad 200 000 stymulatorów rocznie.3 Coraz bardziej zaawansowany poziom techniczny (i wzrastające koszty) tych urządzeń w połączeniu ze starzeniem się populacji i ograniczeniami finansowymi spowodowały, że oparte na dowodach z badań naukowych podejście do leczenia za pomocą wszczepianych urządzeń nabrało większego niż kiedykolwiek znaczenia. W przeglądzie omówiono podstawowe funkcje stymulatorów oraz wskazania do ich stosowania.
Podstawowe funkcje i typy stymulatorów
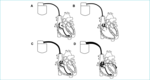
Rycina 1. Schematy przedstawiające najczęściej używane rodzaje stymulatorów. A: Układ do jednojamowej stymulacji komorowej. B: Układ do jednojamowej stymulacji przedsionkowej. C: Układ do stymulacji dwujamowej. D: Układ do stymulacji trójjamowej (dwukomorowej).
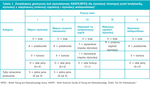
Tabela 1. Zrewidowany generyczny kod stymulatorowy NASPE/BPEG dla stymulacji chroniącej przed bradykardią, stymulacji z adaptowaną (zmienną) częstością i stymulacji wielopunktoweja
Stymulator składa się z generatora impulsów oraz jednej, dwóch lub trzech elektrod (ryc. 1). Generator zawiera baterię, obwody elektryczne i jest połączony z elektrodami za pośrednictwem głowicy. Zwykle wszczepia się go w lewej lub prawej okolicy piersiowej. W wyniku standardowego nakłucia przezskórnego lub wenesekcji uzyskuje się dostęp do żyły podobojczykowej, szyjnej lub pachowej w celu wprowadzenia elektrod i uzyskania dostępu do jamy, która ma być stymulowana: prawego przedsionka, prawej komory lub lewej komory (stymulowanej przez zatokę wieńcową). Stymulator serca wysyła impulsy elektryczne, które depolaryzują mięsień sercowy. Współczesne stymulatory rejestrują sygnały elektryczne pochodzące z jam serca i odpowiadają na zarejestrowane zdarzenia zahamowaniem stymulacji lub wygenerowaniem impulsu. Typ i częstość stymulacji mogą być dodatkowo kontrolowane przez różne algorytmy. Ze względu na duży stopień złożoności stymulatorów i sposobów ich programowania przyjęto ujednoliconą nomenklaturę (tab. 1).5 Tryb funkcjonowania takiego urządzenia opisuje się pięcioliterowym kodem. Pierwsza litera odnosi się do jamy, która jest stymulowana (Atrium – przedsionek, Ventricle – komora lub Dual – obie jamy), druga określa jamę, w której stymulator rejestruje impulsy (Atrium – przedsionek, Ventricle – komora lub Dual – obie jamy), trzecia odnosi się do odpowiedzi na zarejestrowany impuls (Inhibit – hamowanie, Trigger – wyzwalanie, Dual – możliwe obie odpowiedzi), czwarta dotyczy możliwości modulacji częstości stymulacji, a piąta wskazuje stymulację wielopunktową.
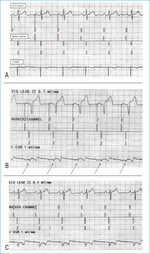
Rycina 2. Podstawowe zachowania stymulatora dwujamowego pracującego w trybie DDD (z czuwaniem i hamowaniem oraz śledzeniem aktywności w kanale przedsionkowym). Kolejność elektrogramów na kolejnych częściach ryciny: u góry – odprowadzenie II standardowego elektrokardiogramu (EKG); pośrodku – kanał znaczników; u dołu – elektrogram komorowy (VEGM). A. Zapis przedstawiający stymulację przedsionkową ze śledzeniem w kanale komorowym. Na początku zapisu widać skuteczną stymulację przedsionków (artefakty stymulacji, po których występują załamki P) z częstością odpowiadającą dolnej granicy częstości rytmu stymulatora (60 uderzeń/min). Stymulacja komorowa jest zahamowana, ponieważ przed upływem zaprogramowanego opóźnienia przedsionkowo-komorowego (280 ms) stymulator rejestruje własną aktywność serca w kanale komorowym. Kiedy częstość własnego rytmu zatokowego zwiększyła się do ≥60 uderzeń na minutę, zahamowana została również stymulacja przedsionkowa i stymulator rejestruje własną aktywność serca zarówno w kanale przedsionkowym (AS), jak i kanale komorowym (VS). B. Zapis przedstawiający sekwencyjną, dwujamową stymulację przedsionkowo-komorową. Dobrze widoczne są artefakty stymulacji przedsionków, po których występują załamki P, co potwierdza skuteczną stymulację przedsionków. Po upływie zaprogramowanego opóźnienia przedsionkowo-komorowego następuje stymulacja komory. W tym przykładzie trudno jest zidentyfikować artefakty stymulacji komorowej w powierzchniowym EKG, ale stymulację potwierdza zapis miejscowego elektrogramu komorowego (strzałki). C. Zapis przedstawiający stymulację komorową zsynchronizowaną z czynnością przedsionków. Własna aktywność serca rejestrowana w kanale przedsionkowym hamuje stymulację przedsionków. Po upływie zaprogramowanego opóźnienia przedsionkowo-komorowego następuje skuteczna stymulacja komory (po każdym impulsie stymulatora występuje zespół QRS).

Rycina 3. Częstoskurcz przedsionkowy u pacjenta ze stymulatorem Guidant Insignia I Entra (Boston Scientific, Natick, Massachussets, USA). Górny zapis przedstawia elektrogram przedsionkowy (AEGM), a dolny zapis elektrogram komorowy (VEGM). Częstoskurcz przedsionkowy został prawidłowo wykryty (co oznaczono jako odpowiedź na częstoskurcz przedsionkowy [atrial tachycardia response – ATR]) i tryb stymulacji uległ zmianie z dwujamowej z czuwaniem i hamowaniem, śledzeniem aktywności w kanale przedsionkowym oraz modulacją częstości rytmu [DDR] na stymulację dwujamową z modulacją częstości rytmu bez śledzenia w kanale przedsionkowym [DDIR] (gwiazdka). W przypadku tego algorytmu po wykryciu arytmii następuje stopniowe zmniejszenie częstości stymulacji komorowej do zaprogramowanej dolnej granicy częstości rytmu stymulatora (fallback). AP-Ns – stymulacja przedsionkowa w okresie rejestrowanego szumu; AS – zdarzenie zarejestrowane w kanale przedsionkowym; ATR-FB – odpowiedź na częstoskurcz przedsionkowy (ATR), początek zwalniania częstości stymulacji komorowej (fallback); EGM – elektrogram; VS – zdarzenie zarejestrowane w kanale komorowym; VP-FB – stymulacja komorowa w ramach odpowiedzi na częstoskurcz przedsionkowy; VP-MT – stymulacja komorowa z maksymalną częstością śledzenia.
Jednojamowe stymulatory przedsionkowe lub komorowe rejestrują sygnały pochodzące z mięśnia sercowego danej jamy, a gdy nie pojawiają się one z zaprogramowaną minimalną częstością, generują impulsy. W przypadku stymulatorów dwujamowych czuwanie i stymulacja następują zarówno w przedsionku, jak i w komorze. W zależności od sytuacji klinicznej i sposobu zaprogramowania urządzenia zarejestrowane sygnały albo wyzwalają, albo hamują stymulację (ryc. 2). Na przykład w trybie stymulacji DDD w czasie sekwencyjnej stymulacji przedsionkowo-komorowej aktywacja przedsionków następuje w razie zwolnienia częstości sygnałów rejestrowanych w kanale przedsionkowym poniżej zaprogramowanego dolnego progu częstości rytmu. Pobudzenie przedsionka wskutek stymulacji wyzwala również impuls aktywujący komorę, który następuje po upływie zaprogramowanego opóźnienia przedsionkowo-komorowego. Stymulacja komory zostaje zahamowana, jeżeli przed upływem tego opóźnienia stymulator zarejestruje pobudzenie własne w kanale komorowym. Jeżeli częstość rytmu przedsionków jest większa od zaprogramowanego dolnego progu, ich stymulacja zostaje zahamowana. Po zarejestrowanym pobudzeniu własnym w kanale przedsionkowym stymulacja komory następuje tylko wtedy, gdy stymulator nie zarejestruje pobudzenia własnego w kanale komorowym do końca zaprogramowanego opóźnienia przedsionkowo-komorowego (ryc. 2). W przypadku przedsionkowych tachyarytmii, takich jak migotanie lub trzepotanie przedsionków, utrzymanie synchronii przedsionkowo-komorowej jest niemożliwe. W kanale przedsionkowym zostaje więc aktywowany tryb stymulacji „bez śledzenia” (tj. stymulacja dwujamowa bez synchronizacji rytmu komór z rytmem przedsionków [DDI] lub tylko stymulacja komorowa hamowana własną aktywnością komór [VVI]), by uniknąć nieprawidłowo szybkiej stymulacji komór. Większość stymulatorów dwujamowych może wykrywać arytmie przedsionkowe i automatycznie przełączać tryby stymulacji w zależności od zmian rytmu przedsionka (ryc. 3).
W przypadku niewydolności chronotropowej, czyli niedostatecznego zwiększania się częstości rytmu serca pod wpływem wysiłku fizycznego, przydatne są stymulatory z adaptowaną (zmienną) częstością stymulacji.5 Urządzenia te mają specjalny czujnik (lub czujniki), którego aktywacja w czasie wysiłku zwiększa częstość stymulacji (z podstawowej do częstości stymulacji w warunkach aktywacji czujnika – sensor rate). Najczęściej stosowane czujniki monitorują ruchy ciała poprzez wykrywanie wibracji (czujniki aktywności lub akcelerometry). Mimo że można je stosować w połączeniu z każdym układem elektrod stymulatora, czujniki wykrywające wibracje są podatne na znaczne interakcje środowiskowe. Bardziej fizjologiczne czujniki wykrywają zmiany wentylacji minutowej, mierząc zmiany impedancji klatki piersiowej zależne od wentylacji lub zmiany długości odstępu QT, które odzwierciedlają aktywację współczulną.6-9 Niektóre stymulatory zawierają więcej niż jeden czujnik, co pozwala ograniczyć wady poszczególnych rodzajów czujników oraz zwiększyć ich swoistość bez pogorszenia czułości.7,9 Często stosuje się połączenie czujnika aktywności z czujnikiem odstępu QT lub wentylacji minutowej. Aby uzyskać optymalne wyniki kliniczne, nieraz konieczne jest uważne programowanie „mieszania” sygnałów z poszczególnych czujników oraz odpowiedzi na ich aktywację.10

Rycina 4. Długoterminowy zapis progu stymulacji jednojamowego stymulatora St. Jude Medical Integrity (St. Jude Medical, St. Paul, Minnesota, USA). Funkcja AutoCapture umożliwia analizę skuteczności stymulacji z pobudzenia na pobudzenie oraz automatyczne modyfikowanie impulsów w zależności od zmieniającej się sytuacji klinicznej. Przedstawiony na rycinie długoterminowy zapis progu stymulacji pochodzi od pacjenta zależnego od stymulatora, u którego nastąpił nagły wzrost tego progu (z 0,75 V do 3,5 V) spowodowany nasileniem przewlekłej niewydolności serca (strzałka). Po wykryciu tej zmiany progu stymulacji stymulator prawidłowo zwiększył napięcie stymulacji. Konwencjonalne zaprogramowanie stymulatora doprowadziłoby zapewne do okresowego braku skutecznej stymulacji. E/R – odpowiedź wywołana; VVIR – stymulacja komorowa hamowana aktywnością własną, z modulacją częstości rytmu.
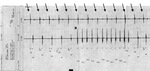
Rycina 5. Częstoskurcz komorowy (V-Tachy) zarejestrowany przez stymulator dwujamowy Guidant Insignia I Entra (Boston Scientific, Natick, Massachussets, USA). Przedstawiono elektrogram przedsionkowy (górny zapis) i komorowy (dolny zapis). Na samym dole zamieszczono zapis z kanału znaczników (czyli tego, co „widzi” stymulator), obejmujący 5 zdarzeń zarejestrowanych w kanale przedsionkowym (AS) oraz wystymulowanych pobudzeń komorowych (VP), a następnie krótki epizod częstoskurczu komorowego składającego się z 12 pobudzeń (oznaczonych w kanale znaczników jako przedwczesne pobudzenia komorowe [VPC]). Widoczne jest rozkojarzenie przedsionkowo-komorowe (strzałki wskazują załamki P, a gwiazdką zaznaczono początek częstoskurczu). AEGM – elektrogram przedsionkowy; EGM – elektrogram; VEGM – elektrogram komorowy; VS – zdarzenie zarejestrowane w kanale komorowym.
Współczesne stymulatory mają możliwość odbierania i zapisywania wielu informacji, które mogą być pomocne w postępowaniu klinicznym, dalszej kontroli pacjentów i rozwiązywaniu problemów. Odczyt stymulatora pozwala na uzyskanie informacji na temat zaprogramowanych parametrów, takich jak tryb i częstotliwość stymulacji, a także parametrów baterii i elektrod. Liczniki zdarzeń, histogramy częstości rytmu serca i zapisy trendów mogą dostarczyć danych na temat częstości, z jaką następuje aktywacja stymulacji, występowania zaburzeń rytmu serca, zmian trybu stymulacji, poziomu aktywności pacjenta, stanu nawodnienia organizmu oraz zmienności częstości rytmu serca. Mogą być też wykorzystywane do monitorowania automatycznych testów progów stymulacji i czuwania (ryc. 4). Zarejestrowane elektrogramy można analizować razem z objawami klinicznymi i wykorzystywać do wykrywania przedsionkowych lub komorowych zaburzeń rytmu serca (ryc. 3 i 5).
Powikłania stymulacji
Ogólnym celem elektroterapii, a zarazem jej wyzwaniem jest naśladowanie prawidłowej aktywacji elektrycznej serca. Mimo że prosta stymulacja komorowa zapobiega znacznej bradykardii, może dojść do rozkojarzenia przedsionkowo-komorowego lub wstecznej aktywacji przedsionków, co prowadzi do zespołu stymulatorowego nawet u 30% pacjentów.11,12 Przyczyny tego zespołu są wieloczynnikowe i obejmują zmiany hemodynamiczne, neurohumoralne i autonomiczne.13,14 Stymulacja komorowa bez odpowiedniej synchronizacji z czynnością przedsionków powoduje, że nie biorą one udziału w napełnianiu komór. Znaczenie pracy przedsionków w generowaniu pojemności minutowej opisano w różnych sytuacjach klinicznych, a hemodynamiczne zalety stymulacji dwujamowej są dobrze znane.15-18 Umożliwia ona bardziej „fizjologiczną” aktywację serca poprzez skoordynowanie skurczu przedsionków i komór oraz zachowanie fizjologicznych zmian częstości rytmu serca u pacjentów z zachowaną czynnością węzła zatokowego i blokiem przewodzenia przedsionkowo-komorowego. Optymalne zsynchronizowanie skurczu przedsionków i komór umożliwia lepsze napełnianie tych ostatnich, zwiększa pojemność minutową, zapobiega niedomykalności zastawek przedsionkowo-komorowych oraz chroni przed wzrostem ciśnienia w przedsionkach dzięki unikaniu ich skurczu w momencie, w którym zastawki przedsionkowo-komorowe są zamknięte. Zespół stymulatorowy może powodować nasilone objawy, np. zawroty głowy, osłabienie, niewydolność serca oraz zasłabnięcia lub omdlenia. Prowadzi również do migotania przedsionków i wiąże się z częstszym występowaniem udarów mózgu.19-22 Czasami objawy są mało nasilone i nieswoiste.18 Można im w znacznym stopniu zapobiegać lub je znosić, przywracając synchronię skurczu przedsionków i komór. Wyniki prób klinicznych, w których porównywano różne tryby stymulacji, omówiono w części „Wskazania do stymulacji”.
Coraz częściej zwraca się też uwagę na związek między długotrwałą stymulacją wierzchołka prawej komory a zmianami patologicznymi i zwiększeniem chorobowości.23-25 Asynchronia skurczu komór wynikająca ze stymulacji wierzchołka prawej komory może być przyczyną dysfunkcji i niewydolności serca.26-33 Jako alternatywną metodę postępowania zaproponowano unikanie stymulacji wierzchołka prawej komory dzięki stosowaniu algorytmów sprzyjających zachowaniu prawidłowego przewodzenia przedsionkowo-komorowego u pacjentów z zespołem chorego węzła zatokowego lub wykorzystywaniu innych miejsc stymulacji (np. umieszczaniu elektrody prawokomorowej w połowie długości przegrody międzykomorowej).32,33 Ustalenie korzyści z takiego postępowania wymaga zebrania więcej danych.
Dyssynchronię skurczu komory, która może być spowodowana uszkodzeniem układu bodźcoprzewodzącego, takim jak blok lewej odnogi pęczka Hisa, powiązano z niekorzystnym rokowaniem u pacjentów z niewydolnością serca i dysfunkcją skurczową.34,35 Opóźnienie przewodzenia wewnątrzkomorowego jest przyczyną znacznej niejednorodności momentu skurczu różnych obszarów mięśnia lewej komory zarówno w jej osi długiej, jak i promieniście od niej, co powoduje dyssynchronię aktywności mechanicznej w obrębie komory.36 Dyssynchronia skurczu prowadzi do zwiększenia pracy wykonywanej przez lewą komorę, nasilenia niedomykalności mitralnej z powodu opóźnienia aktywacji mięśni brodawkowatych, a także skrócenia czasu napełniania rozkurczowego.36-38 Stymulacja dwukomorowa (tj. stymulacja zarówno prawej, jak i lewej komory) wpływa na poprawę czynności skurczowej i rozkurczowej lewej komory w wyniku „zsynchronizowania” skurczu, co wymaga wszczepienia trzeciej elektrody do jednego z bocznych odgałęzień zatoki wieńcowej (ryc. 1). Stymulacja dwukomorowa, zwana również terapią resynchronizującą serce, jest dodatkową metodą terapii pacjentów z niewydolnością serca III lub IV klasy czynnościowej według New York Heart Association (NYHA), u których stosuje się optymalne leczenie zachowawcze oraz stwierdza opóźnienie przewodzenia wewnątrzkomorowego lub blok odnogi pęczka Hisa.1