Za skierowaniem chorego do PCI przemawiają w szczególności następujące czynniki:
- zwężenie pnia lewej tętnicy wieńcowej lub choroba wielonaczyniowa z niskim wynikiem (0-22 pkt) w skali SYNTAX
- obecność ciężkich chorób współistniejących (których nie odzwierciedlają odpowiednio skale ryzyka)
- zaawansowany wiek pacjenta, zespół kruchości, krótka oczekiwana długość dalszego życia
- ograniczenie zdolności poruszania się i inne stany wpływające negatywnie na proces rehabilitacji po zabiegu kardiochirurgicznym
- anatomia zmian w tętnicach wieńcowych, która najprawdopodobniej będzie przyczyną niepełnej rewaskularyzacji za pomocą CABG z powodu złej jakości obwodów naczyń lub ich braku
- ciężkie zniekształcenie klatki piersiowej lub boczne skrzywienie kręgosłupa
- następstwa napromieniania klatki piersiowej
- aorta porcelanowa.
Przezskórne interwencje wieńcowe w NSTE-ACS
Podstawowe zasady wykonywania PCI w obrębie tętnicy odpowiedzialnej za wystąpienie NSTE-ACS są podobne jak w przypadku pierwotnej PCI w STEMI. Dotyczy to zwłaszcza pacjentów, u których tętnica odpowiedzialna za incydent jest wyjściowo niedrożna lub zwężona z powodu obecności skrzepliny pokrywającej pękniętą lub owrzodziałą blaszkę miażdżycową (zawał serca typu 1 według czwartej uniwersalnej definicji zawału serca10). U stabilnych hemodynamicznie pacjentów z NSTE-ACS i chorobą wielonaczyniową można rozważyć jednoczesną rewaskularyzację pozostałych naczyń, jednak tylko w przypadku niepowikłanego przebiegu PCI w obrębie tętnicy odpowiedzialnej za incydent i dogodnej anatomii pozostałych zwężeń wymagających interwencji. U pozostałych pacjentów rewaskularyzacja naczyń nieodpowiedzialnych za wystąpienie NSTE-ACS powinna się odbyć w kolejnym etapie, z zachowaniem zasad kwalifikacji analogicznych do tych obowiązujących chorych ze STEMI.
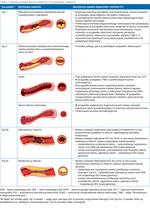
Samoistne rozwarstwienie tętnicy wieńcowej (SCAD – spontaneous coronary artery dissection) definiowane jest jako odwarstwienie błon wchodzących w skład ściany tętnicy wieńcowej, niewynikające z miażdżycy, urazu ani czynników jatrogennych, wtórne do krwawienia z naczyń w obrębie ściany naczyniowej (vasa vasorum) lub przerwania ciągłości błony wewnętrznej, które prowadzi do powstania światła rzekomego, ucisku tętnicy wieńcowej i niedokrwienia mięśnia sercowego w obszarze zaopatrywanym przez to naczynie. Samoistne rozwarstwienie tętnicy wieńcowej odpowiada za nawet 4% wszystkich ACS, ale odnotowywana częstość tego zjawiska jest zdecydowanie większa (22-35% ACS) u kobiet w wieku <60 lat, w przypadku zawału serca związanego z ciążą, u pacjentów z dysplazją włóknisto-mięśniową, lękiem, depresją i wcześniejszymi zaburzeniami neuropsychicznymi w wywiadzie.
Obraz kliniczny może być bardzo zróżnicowany, jednak najczęstszym objawem jest wzrost poziomu biomarkerów sercowych skojarzony z dyskomfortem w klatce piersiowej. Wyróżnia się 3 angiograficzne typy SCAD, z zakresem zmian od braku zwężenia do całkowitego zamknięcia zajętych tętnic wieńcowych. Typ 1 SCAD (wysycenie środkiem kontrastowym ściany tętnicy ze zwielokrotnieniem światła przeziernym dla promieniowania rentgenowskiego) oraz typ 2 SCAD (długie, rozlane i gładkościenne zwężenie) tętnic wieńcowych bez angiograficznie istotnego zwężenia (ze zwężeniem <50%) opisuje się jako możliwe przyczyny zawału serca bez istotnych zmian tętnic wieńcowych (MINOCA – myocardial infarction with non-obstructive coronary arteries), natomiast typ 2 z obecnością poważnego zwężenia tętnicy wieńcowej (>50%) i typ 3 (ogniskowe lub cewkowe zwężenie imitujące miażdżycę) należy rozpatrywać osobno. Techniki obrazowania wewnątrzwieńcowego (IVUS, OCT) mogą stanowić optymalne metody diagnostyczne w niejednoznacznych sytuacjach, ponieważ pozwolą stwierdzić obecność krwiaka śródściennego lub podwójnego światła naczynia. Nowe wytyczne ESC z 2020 r. o postępowaniu w NSTE-ACS zalecają rewaskularyzację (PCI lub CABG) jedynie w przypadku niedrożności lub ciasnego zwężenia tętnicy spowodowanego SCAD z ostrymi objawami niedokrwienia i/lub niestabilnością hemodynamiczną. W pozostałych sytuacjach zaleca się postępowanie zachowawcze, które prowadzi z reguły do samoistnego wygojenia ściany naczynia.
W tabeli 1 podsumowano metody postępowania w zależności od morfologii zwężenia.
Leczenie kardiochirurgiczne w ostrych zespołach wieńcowych
Wykonania pilnego zabiegu CABG wymaga 5-10% pacjentów z zawałem serca i zaawansowaną chorobą wieńcową (kompleksowe zwężenie pnia głównego lewej tętnicy wieńcowej i/lub zaawansowana choroba wielonaczyniowa, zwłaszcza przy współistniejącej cukrzycy). Dotyczy to częściej chorych z rozpoznaniem NSTE-ACS niż pacjentów ze zdiagnozowanym STEMI. Chorzy ci stanowią trudną grupę ze względu na duże ryzyko okołooperacyjne w porównaniu z pacjentami poddawanymi zabiegom planowym. U pacjentów z trwającym niedokrwieniem lub niestabilnością hemodynamiczną, których zakwalifikowano do zabiegu CABG, operację przeprowadza się w trybie nagłym (nie wolno jej odkładać ze względu na zastosowanie wcześniej DAPT). Chorych wyjściowo stabilnych hemodynamicznie bez klinicznych objawów nawrotu niedokrwienia operuje się zwykle po kilku dniach stabilizacji farmakologicznej, optymalnie po odstawieniu DAPT (3 dni po wyłączeniu tikagreloru, 5 dni po odstawieniu klopidogrelu i 7 dni po odstawieniu prasugrelu).
Za skierowaniem chorego na CABG przemawiają w szczególności następujące czynniki:
- zwężenie pnia lewej tętnicy wieńcowej i/lub choroba wielonaczyniowa z umiarkowanym (23-32 pkt) lub wysokim (≥33 pkt) wynikiem w skali SYNTAX
- cukrzyca
- upośledzona czynność lewej komory (frakcja wyrzutowa lewej komory [LVEF – left ventricle ejection fraction] ≤35%)
- przeciwwskazania do DAPT
- nawracająca rozlana restenoza w stentach
- anatomia zmian w tętnicach wieńcowych, która najprawdopodobniej będzie przyczyną niepełnej rewaskularyzacji za pomocą PCI
- bardzo zwapniałe zmiany w tętnicach wieńcowych, z ograniczoną możliwością ich poszerzenia balonem
- inne wskazania do operacji kardiochirurgicznej (powikłania mechaniczne, tętniak aorty wstępującej, wady zastawkowe itp.).
U chorych z utrzymującym się niedokrwieniem lub niestabilnością hemodynamiczną i wskazaniem do CABG należy wykonać pilną operację, bez opóźnienia spowodowanego stosowaniem u pacjenta leczenia przeciwpłytkowego.
Jednym ze wskazań do pilnego leczenia kardiochirurgicznego w przebiegu zawału serca jest również wystąpienie powikłań mechanicznych zawału. Do pozawałowego pęknięcia przegrody międzykomorowej, pęknięcia wolnej ściany lewej komory i niedokrwiennej ostrej niedomykalności mitralnej dochodzi rzadko, ale powikłania te w znacznym stopniu wpływają na całkowitą śmiertelność z powodu zawału serca. Pęknięcie przegrody międzykomorowej zwykle objawia się gwałtownym pogorszeniem stanu klinicznego z ostrą niewydolnością serca lub wstrząsem kardiogennym. W stabilizacji stanu pacjentów przed koronarografią i/lub operacją może pomóc zastosowanie kontrapulsacji wewnątrzaortalnej (IABP – intra-aortic balloon pump).
Nie ma zgody co do optymalnego czasu wykonania operacji naprawczej. Z wczesną operacją wiąże się wysoka śmiertelność okołozabiegowa i wysokie ryzyko nawrotu pęknięcia. Z kolei opóźniona operacja pozwala na łatwiejszą naprawę uszkodzonej, rozrywającej się przegrody, ale obarczona jest ryzykiem powiększenia się pęknięcia i zgonu pacjenta w oczekiwaniu na zabieg. Przeżycie w przypadku pęknięcia wolnej ściany lewej komory zależy od natychmiastowej diagnozy, odbarczenia tamponady, stabilizacji hemodynamicznej i szybkiej interwencji chirurgicznej. Ostra niedomykalność zastawki mitralnej może wystąpić w okresie 2-7 dni po zawale serca w wyniku pęknięcia mięśnia brodawkowatego lub strun ścięgnistych. Leczenie operacyjne jest metodą z wyboru, ale wiąże się z nim duża śmiertelność operacyjna. Wymiana zastawki mitralnej jest często jedyną możliwością leczenia, aczkolwiek znane są opisy przypadków udanej naprawy zastawki.
Leczenie zachowawcze w ostrych zespołach wieńcowych
Pacjenci z NSTEMI, po koronarografii, z rozpoznaną ciężką chorobą wieńcową bez możliwości jakiejkolwiek rewaskularyzacji są obciążeni dużym ryzykiem nawrotu zdarzeń niedokrwiennych. W tej grupie ryzyko zabiegu przewyższa korzyści, dlatego u tych chorych należy prowadzić agresywne leczenie w ramach prewencji wtórnej z silną terapią przeciwpłytkową i przeciwdławicową, przy uwzględnieniu chorób współistniejących. Wśród chorych z NSTEMI możemy wyróżnić także pacjentów niebędących kandydatami do koronarografii, u których korzyści ze strategii inwazyjnej są ograniczone, a ryzyko zabiegu zbyt duże. Czynniki przemawiające za leczeniem zachowawczym (raczej w kombinacji) to: zaawansowany wiek, przewlekła choroba nerek, cukrzyca, rozpoznana niewydolność serca/przebyta rewaskularyzacja, choroba nowotworowa oraz zespół kruchości.
Podsumowanie
Upowszechnienie leczenia interwencyjnego ostrych zespołów wieńcowych doprowadziło w ostatnich 20 latach do dużej poprawy rokowania wczesnego i odległego w tej grupie chorych. Dotyczy to przede wszystkim pacjentów ze STEMI oraz z NSTE-ACS bardzo wysokiego i wysokiego ryzyka. Zdecydowana większość pacjentów z zawałem serca poddawana jest rewaskularyzacji przezskórnej, także w obrębie tętnic nieodpowiedzialnych za wystąpienie zawału. Rewaskularyzacja chirurgiczna jest wykonywana znacznie rzadziej, przede wszystkim u pacjentów ze zwężeniem pnia głównego lewej tętnicy wieńcowej i/lub chorobą wielonaczyniową, kiedy leczenie przezskórne jest obarczone zbyt dużym ryzykiem, niemożliwe lub nieskuteczne. Leczenie kardiochirurgiczne jest również wskazane u pacjentów z mechanicznymi powikłaniami zawału serca.