Zalecenia American Academy of Neurology (AAN) z 2018 r. precyzują: lekarz powinien rozważyć i omówić z pacjentem zmianę DMT, jeśli wystąpiły ≥1 rzut, ≥2 nowe zmiany w MR lub postęp niesprawności w ciągu roku stosowania DMT (poziom zalecenia B)18.
Decyzja o zmianie terapii powinna uwzględniać mechanizm działania leku. Obecnie DMT możemy podzielić na:
- leki immunomodulujące (interferon β, octan glatirameru, fumaran dimetylu, teryflunomid (również mechanizm deplecji)
- leki blokujące przemieszczanie się komórek immunologicznych (natalizumab, fingolimod)
- leki skutkujące deplecją komórek układu immunologicznego (mitoksantron, cyklofosfamid, kladrybina, okrelizumab, alemtuzumab).
Mechanizm działania ma znaczenie przy planowaniu sekwencji stosowania leków DMT w SM, również uwzględniając ryzyko działań niepożądanych, np. postępującej leukoencefalopatii wieloogniskowej (PML – progressive multifocal leukoencephalopathy). Stosowanie natalizumabu wiąże się ze zwiększonym ryzykiem PML, włączenie tego leku np. po wcześniej stosowanym fumaranie dimetylu, również związanym z ryzykiem PML, powoduje multiplikowanie ryzyka.
Ryzyko postępującej leukoencefalopatii wieloogniskowej jest odrębnym zagadnieniem podnoszonym w rekomendacjach dotyczących DMT. Jest to groźne dla życia powikłanie, którego ryzyko musi być kalkulowane podczas planowanej zmiany DMT. Obecność przeciwciał przeciwko wirusowi JC, wysoki indeks przeciwciał, wcześniejsze leczenie immunosupresyjne i długi czas trwania terapii natalizumabem zwiększają ryzyko PML19. Obecnie szacuje się małe ryzyko PML u pacjentów z indeksem przeciwciał <0,9, a zwiększone u pacjentów z wartością indeksu >1,5 i po ponad 2 latach terapii natalizumabem. Zdecydowanie rzadziej – ale jednak – odnotowuje się przypadki PML podczas terapii fingolimodem, fumaranem dimetylu i okrelizumabem, pacjenci powinni być zatem informowani o ryzyku tej choroby (poziom zalecenia B). U chorych leczonych natalizumabem ponad 2 lata i z indeksem >0,9 powinno się rozważyć zmianę DMT (poziom zalecenia B).
Zakończenie terapii natalizumabem wiąże się z ryzykiem zaostrzenia SM w ciągu 6 miesięcy, istnieją nieliczne doniesienia o optymalnej terapii po stosowaniu tego leku. Na podstawie piśmiennictwa można sądzić, że zmiana terapii na fingolimod w ciągu 8-12 tygodni po zaprzestaniu podawania natalizumabu przynosi pacjentom korzyść wyrażoną w ocenie aktywności klinicznej i wyników MR w porównaniu z odroczoną zmianą leku o 16 tygodni (poziom rekomendacji B)20.
Opierając się na wynikach rejestru MSBase, alemtuzumab i natalizumab charakteryzują się podobnym wpływem na roczny wskaźnik rzutów w SM. Alemtuzumab wydaje się korzystniejszy niż fingolimod i interferon β w kontekście aktywności rzutowej, jednak natalizumab ma lepszy wpływ niż alemtuzumab na progresję SM. Decyzje dotyczące wyboru terapii powinny przede wszystkim opierać się na analizie profilu bezpieczeństwa natalizumabu i alemtuzumabu.
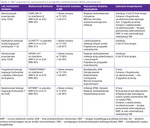
Planowanie kolejnej DMT dla pacjenta powinno uwzględniać możliwość kumulacji ryzyka działań niepożądanych, okres eliminacji leku i ryzyko nawrotu/nasilenia choroby w okresie wcześniejszego odstawienia leku (tab. 3). Jeśli stosujemy u pacjenta lek, który zatrzymuje limfocyty w węzłach chłonnych, np. fingolimod, z suboptymalnym efektem, to podanie w ramach kolejnej terapii leku o mechanizmie opartym na wpływie na krążące limfocyty, jak w przypadku alemtuzumabu, jest ryzykowne. Po zaprzestaniu podawania fingolimodu stężenie limfocytów normalizuje się w ciągu 2-4 tygodni; po upływie 4 tygodni i uzyskaniu pewności, że limfocyty wróciły do normy, można bezpiecznie podać alemtuzumab i równocześnie wykorzystać jego wpływ na krążące limfocyty21,22. Z punktu widzenia bezpieczeństwa zmiana terapii z natalizumabu, fingolimodu (i prawdopodobnie fumaranu dimetylu) – leków, które w monoterapii niosą ryzyko PML – na terapię alemtuzumabem wymaga szczególnej ostrożności.
Przed zmianą terapii należy wcześniej zaplanować testy wymagane dla bezpiecznego przełączenia leczenia. Określenie stężenia przeciwciał anty-JCV jest rekomendowane u wszystkich pacjentów rozpoczynających terapię natalizumabem, ale również przed rozpoczęciem kolejnej terapii po natalizumabie, fumaranie dimetylu i fingolimodzie. Pacjenci, u których planowane jest włączenie terapii fingolimodem, powinni podczas kwalifikacji być oceniani w kierunku chorób układu krążenia, cukrzycy, uszkodzenia wątroby, profilu lipidów w surowicy oraz skontrolowani pod kątem obecności przeciwciał przeciw varicella zoster lub odpowiednio zaszczepieni23.
Zmiana DMT wymaga podjęcia kolejnej decyzji: kiedy nowy lek można bezpiecznie wprowadzić. Nie jest zalecane równoczesne przyjmowanie leków ze względu na kumulacje działania immunosupresyjnego i zwiększenie ryzyka powikłań. Ważna jest znajomość okresu półtrwania leku i mechanizmu działania wcześniejszego leku. Okres eliminacji nie jest wymagany przy zmianie terapii z interferonu czy octanu glatirameru24. Przyspieszony schemat eliminacji jest wymagany po zaprzestaniu terapii teryflunomidem w związku z długim okresem półtrwania. Przy przechodzeniu z fingolimodu na alemtuzumab potrzebny jest co najmniej 4-tygodniowy okres przerwy. Z uwagi na możliwą limfopenię związaną z terapią fumaranem dimetylu również w przypadku tego leku rekomenduje się przerwę do 4 tygodni przed przejściem na fingolimod czy natalizumab25. W związku z ryzykiem PML po leczeniu natalizumabem, fumaranem dimetylu czy fingolimodem przed kolejną terapią, np. alemtuzumabem czy okrelizumabem, zaleca się wykonanie badania MR, tzw. exit MRI, i ocenę PCR JCV w płynie mózgowo-rdzeniowym.
W sytuacji, kiedy nie można u pacjenta kontynuować DMT o dużej skuteczności czy to z powodu działań niepożądanych, czy suboptymalnej odpowiedzi, powinniśmy rozważyć zmianę na inny lek o dużej skuteczności, biorąc pod uwagę następujące czynniki:
- aktywność choroby (kliniczną i/lub ocenianą w MR); im wyższa aktywność choroby, tym szybciej należy rozpocząć nową terapię
- okres półtrwania i aktywność biologiczną wcześniejszej terapii
- ryzyko nawrotu aktywnej choroby czy nawet wyższej aktywności.
Czy zaprzestanie DMT jest możliwe i bezpieczne? Na podstawie analizy rejestru pacjentów MSBase, obejmującej chorych bez aktywności rzutowej w ostatnich 5 latach, wykazano, że 485 pacjentów, którzy zaprzestali DMT, nie różniło się istotnie w zakresie parametru, jakim jest czas do pierwszego rzutu, w porównaniu z 854, którzy kontynuowali terapię. Jednak już ocena ryzyka utrwalonej progresji SM wypadła korzystniej w grupie, która kontynuowała terapię30. W tabeli 3 zamieszczono informacje na temat mechanizmów działania, skuteczności, działań niepożądanych i rekomendacji dotyczących planowania DMT w przypadku nieskuteczności leku pierwszego wyboru.