Do scharakteryzowania nowotworów jamy ustnej stosujemy klasyfikację klinicznego zaawansowania TNM i patomorfologicznego zaawansowania pTNM wg Union for International Cancer Control/American Joint Committee on Cancer (UICC/AJCC), zmodyfikowaną w latach 2008-2009. Ocenę według klasyfikacji pTNM przeprowadza się w oparciu o badanie patomorfologiczne u chorych po radykalnym leczeniu chirurgicznym. W odniesieniu do regionalnego układu chłonnego, jako pNO można określić węzły chłonne, w których po zabiegu elektywnym (grupy I-III węzłów chłonnych szyi) nie stwierdzono obecności zmian przerzutowych w minimum sześciu węzłach chłonnych. Po operacjach radykalnych układu chłonnego szyi (węzły grupy I-V) w badaniu mikroskopowym należy ocenić przynajmniej 10 węzłów.[3]
Leczenie
Wywiad, kompletne badanie fizykalne, uzupełnione o badania obrazowe, identyfikacja histopatologiczna nowotworu – to składowe pozwalające tworzyć plan kompleksowego leczenia dla indywidualnego pacjenta. Wybór sposobu leczenia podejmowany jest na podstawie analizy trzech składowych: charakterystyki nowotworu, pacjenta, możliwości leczenia. Poza ogólną kondycją, wiekiem chorego, obecnością schorzeń współistniejących, stanem układu płucno-sercowego, możliwością podjęcia rehabilitacji pooperacyjnej, uwzględnienie woli i akceptacji chorego dla często okaleczającego leczenia ma znaczenie decydujące. Adekwatne leczenie dla tych chorych może zapewnić jedynie doświadczony zespół chirurgów głowy i szyi oraz radioterapeutów, pracujący w wysokospecjalistycznych ośrodkach medycznych.
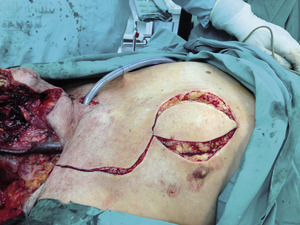
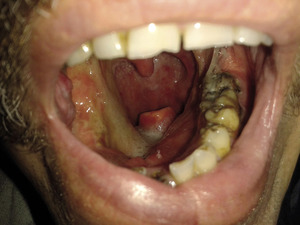
Podstawą radykalnego leczenia pozostaje zabieg chirurgiczny. Celem leczenia chirurgicznego jest całkowite usunięcie guza pierwotnego wraz z regionalnymi węzłami chłonnymi podejrzanymi o obecność przerzutów, przy zachowaniu struktur nieobjętych procesem nowotworowym (fot. 2, 3). Minimalny margines to przynajmniej 5 mm zdrowej tkanki w ocenie histopatologicznej. Podobnie założenia radioterapii stawiają za cel efektywne zniszczenie komórek nowotworowych przy maksymalnym oszczędzeniu tkanek zdrowych.[4] Wczesne postacie raka jamy ustnej T1 i T2 mogą być efektywnie leczone zarówno chirurgicznie, jak i przy zastosowaniu radioterapii. Druga z tych metod nie jest polecana z uwagi na fakt, że w obszarze napromienianym znajduje się kość żuchwy (osteoradionecrosis), jak również ze względu na uciążliwe dla chorego działania niepożądane, szczególnie suchość w jamie ustnej.[2] Najlepszy sposób postępowania z rakami T3 i T4 to leczenie skojarzone. Chorzy z zaawansowanymi postaciami guzów T3 i T4 wymagają rozległej resekcji guza pierwotnego oraz wykonanego jednocześnie kompleksowego zabiegu rekonstrukcyjnego (fot. 4). Pierwszym etapem leczenia chirurgicznego jest zwykle tracheotomia, zapewniająca prawidłową wentylację w czasie i po operacji.
Leczenie chirurgiczne zależy od stopnia zaawansowania nowotworu. Chorzy z zaawansowaniem raka T1N0 wymagają resekcji guza pierwotnego wraz z węzłami chłonnymi grupy I, II, i III na szyi po stronie guza. Niski stopień zróżnicowania histopatologicznego G3, skłania do rozważenia brachyterapii, która może być zastosowana powyżej 0,5 cm od żuchwy z wykluczeniem koniuszka języka. U chorych z zaawansowaniem guza T2N0 wykonywana jest resekcja guza pierwotnego wraz z węzłami chłonnymi grupy I, II, III na szyi po stronie guza; uzupełniająca radioterapia stosowana jest zależnie od wyniku badania histopatologicznego. Zmiany T3N0 i T4N0 wymagają resekcji guza pierwotnego, połączonej z resekcją fragmentu żuchwy, jednoczesną rekonstrukcją ubytku tkanek; wycięcia regionalnych węzłów chłonnych grupy I, II, III na szyi po stronie guza; uzupełniającej radio- lub radiochemioterapii, zależnie od czynników rokowniczych.[3] Chorzy w III i IV stopniu zaawansowania choroby nowotworowej, którzy nie kwalifikują się do zabiegu operacyjnego, poddani są chemioradioterapii. Metoda ta wykorzystywana jest także jako terapia alternatywna dla rozległych, okaleczających resekcji, jak również w leczeniu chorych, u których stwierdzono obecność niekorzystnych prognostycznie czynników patomorfologicznych. Napromienianie łączy się rutynowo z cisplatyną.[3]
W wyniku bogato rozwiniętej sieci naczyń chłonnych jamy ustnej raki tej okolicy charakteryzuje wysoka skłonność do występowania przerzutów w regionalnych węzłach chłonnych. W postępowaniu terapeutycznym należy zawsze uwzględnić leczenie regionalnego układu chłonnego. Występowanie zmian metastatycznych znacznie pogarsza rokowanie co do przeżycia chorych, o około 50 proc.[12] Obecność przerzutów w regionalnych węzłach chłonnych wymaga wykonania resekcji układu chłonnego szyi. Rodzaj zabiegu, tj. selektywna, radykalna zmodyfikowana lub radykalna dyssekcja układu limfatycznego szyi, zależy od stopnia zaawansowania zmian metastatycznych N1-N3. Zabieg chirurgiczny uzupełniany jest radio- lub chemioterapią, w zależności od klinicznego zaawansowania raka jamy ustnej.[3] Ocenia się, że 20-40 proc. przypadków raka jamy ustnej daje przerzuty do regionalnych węzłów chłonnych, zazwyczaj poziomu I do III, poziom IV to 7-17 proc., natomiast wyjątkowo rzadko zmianami metastatycznymi objęty jest poziom V, od 0 do 6 proc.[10]
Ocena histopatologiczna materiału pooperacyjnego powinna określać typ histologiczny guza, stopień zróżnicowania histopatologicznego, głębokość naciekania, zajęcie naczyń krwionośnych i limfatycznych, naciekanie tkanek okołonerwowych i okolicznych struktur.[10] W ocenie histopatologicznej układu chłonnego szyi zaleca się zwiększenie liczby przekrojów węzła chłonnego poddanych ocenie. Najmniej pomyślną rokowniczo cechą histopatologiczną, której obecność skutkuje skróceniem okresu przeżycia o ok. 50 proc., jest naciekanie uszkadzające torebkę węzła chłonnego.[2] Większość chirurgów głowy i szyi przyjmuje, że przy guzie wielkości 4 cm i większym wzrasta ryzyko przerzutów węzłowych. Zalecają wtedy u chorych z N0 wykonanie elektywnego zabiegu resekcji układu chłonnego na szyi.[2]
Chirurgia i radioterapia to metody stosowane w leczeniu raka jamy ustnej rozdzielnie lub w kombinacji, razem lub bez terapii systemowej – chemioterapii i terapii celowanej. Radioterapia stosowana jest w trzech sytuacjach:
- jako terapia adjuwantowa w stosunku do pierwotnego leczenia chirurgicznego,
- w celu wzmocnienia kontroli ogniska pierwotnego i regionalnego układu chłonnego, jako leczenie podstawowe dla chorych niekwalifikujących się do operacji,
- w leczeniu nawrotów i nieradykalności leczenia podstawowego.[1]
W większości raków jamy ustnej, nawet mimo wczesnego zaawansowania, leczenie chirurgiczne zwykłe uzupełniane jest radioterapią. Napromienianiem należy objąć lożę po guzie wraz z okolicą anatomiczną, w której był zlokalizowany oraz elektywnie część lub całość układu limfatycznego szyi.[3] Radioterapia i radiochemioterapia zalecana jest w zaawansowanych postaciach guza pierwotnego T3 i T4, wąskim lub dodatnim marginesem resekcji guza, przy stwierdzonym naciekaniu tkanek okołonerwowych naczyń krwionośnych czy obecności przerzutowych zmian węzłowych.[10] Całkowita dawka radioterapeutyczna jest dzielona na dawki pojedyncze w sposób frakcjonowany konwencjonalnie (1,8–2,0 Gy dziennie, przez pięć dni w tygodniu), sposobem przyspieszonym (> 10 Gy tygodniowo) lub hyperfrakcjonowanym (1,1-1,2 Gy dwa razy dziennie). W metodzie frakcjonowania konwencjonalnego całkowita dawka wynosi ok. 70 Gy. Hypofrakcjonowanie, stosowane głównie w postępowaniu paliatywnym, charakteryzują znacznie większe niż 1,8-2,0 Gy dawki pojedyncze. Hyperfrakcjonowanie to mniejsze, ale częściej stosowane dawki pojedyncze, co umożliwia zwiększenie dawki całkowitej. Pooperacyjną radioterapię należy rozpocząć i zakończyć możliwie jak najwcześniej, ale nie później niż 11 tygodni po operacji.[10]
U chorych bez przerzutów odległych M0, którzy nie kwalifikują się do leczenia chirurgicznego, a u których nie doszło do naciekania żuchwy, w zależności od zaawansowania nowotworu i stanu ogólnego chorego polecana jest radiochemioterapia i radioterapia radykalna lub paliatywna. U chorych z naciekaniem żuchwy jako postępowanie niestandardowe – indukcyjna chemioterapia z resekcją w przypadku uzyskania regresji, chemioterapia paliatywna lub leczenie objawowe.[3] W przypadkach o stwierdzonych przerzutach odległych stosujemy postępowanie indywidualne, paliatywną radio- lub chemioterapię i leczenie objawowe.[3]
Podawanie cisplatyny w monoterapii daje równie dobre efekty jak w polichemioterpaii, natomiast gorsze wyniki są obserwowane w polichemioterapii bez cisplatyny. Aktualnie nie istnieją poparte dowodami badania, że stosowana paliatywnie radio- lub chemioterapia wpływa na przedłużenie życia chorych niekwalifikujących się do leczenia radykalnego.[10]
Najnowsza metoda, stosowana od niedawna w leczeniu nowotworów płaskonabłonkowych, to leczenie ukierunkowane molekularnie – terapia celowana. Przykładem terapii celowanej w leczeniu raków płaskonabłonkowych głowy i szyi jest podawanie cetuksymabu, przeciwciała monoklonalnego, przeciwko receptorowi nabłonkowego czynnika wzrostu (EGFR). Lek ten rekomendowany jest w leczeniu skojarzonym z radioterapią w chorobie miejscowo zaawansowanej oraz w skojarzeniu z chemioterapią cisplatyną, w leczeniu nawrotów i przerzutów.[14]
Jednym z głównych komponentów leczenia chirurgicznego obok resekcji guza z zachowaniem marginesu tkanek zdrowych jest rekonstrukcja rozległego zazwyczaj ubytku tkanek. Jedynie niewielkie guzy mogą być usunięte z dostępu transoralnego. Większość wymaga wykonania szerokiego dostępu przez mandibulotomię. Oczekiwania pacjentów związane z efektem funkcjonalnym, estetycznym i jakością życia po przebytych operacjach są duże. Chirurgia rekonstrukcyjna z wykorzystaniem płatów z mikrozespoleniami naczyniowymi wydaje się w największym stopniu zaspokajać te oczekiwania. Płaty, które znalazły zastosowanie w rekonstrukcjach ubytków w obrębie jamy ustnej, pochodzą z obszarów o relatywnie nieskomplikowanej anatomii, niestwarzającej trudności w pobraniu przeszczepu.
Przeszczep promieniowy z przedramienia jest najchętniej stosowany. Płaty z mięśnia prostego brzucha i mięśnia najszerszego grzbietu, płat boczny ramienny czy płat przednio-boczny z uda stosowane są do zaopatrzenia dużych objętościowo ubytków tkanek.[15] Ubytki tkanek po usuniętych guzach można również zaopatrzyć wyspowymi płatami skórno-mięśniowymi z sąsiedztwa. Do najczęściej stosowanych płatów należy płat wyspowy z mięśnia piersiowego większego – płat Ariyana (fot. 5, 6). Ciągłość kości żuchwy resekowanej w przypadkach zaawansowanych można przywrócić, montując płytki tytanowe w kształcie usuniętych fragmentów. Pozwala to zmniejszyć deformację twarzy, a także zaburzenia połykania i artykulacji. Rekonstrukcje kości żuchwy wymagają znacznych umiejętności. Przeprowadzane są z wykorzystaniem przeszczepów kostno-mięśniowo-skórnych z grzebienia kości biodrowej, łopatki lub kości piszczelowej. W późniejszym etapie leczenia w przeszczep kostny można osadzać implanty zębów.[14] Połączenie mikronaczyniowe można wykonać, gdy odpowiednie naczynia są dostępne w obszarze ubytku tkanek. Rozległe wcześniejsze operacje w obrębie głowy i szyi, zakażenia, ogólnie zła kondycja naczyniowa chorego i przebyta radioterapia ograniczają możliwość przeprowadzenia rekonstrukcji wykorzystującej mikrozespolenia naczyniowe. W przypadkach o niedostatecznym zaopatrzeniu naczyniowym znalazły zastosowanie techniki chirurgiczne z wykorzystaniem naczyń piersiowo-barkowych, interpozycji płata lub pętli naczyniowej oraz żyły odpromieniowej, przy niedostatecznym zaopatrzeniu żylnym. Wgojenie przeszczepu z mikrozespoleniem w 90-95 proc. przypadków zakończone jest sukcesem. Zakrzep w szypule naczyniowej jest najczęstszą przyczyną utraty przeszczepu, co wymaga natychmiastowego pobrania drugiego płata. Sukces przebytego zabiegu naprawczego należy oceniać po uwzględnieniu oceny subiektywnej chorego dotyczącej zakresu funkcjonowania i estetyki zastosowanej rekonstrukcji.[15]
Dla przywrócenia zdolności żucia chorzy poddani leczeniu chirurgicznemu i radioterapii powinni być objęci leczeniem protetycznym, z zastosowaniem protez konwencjonalnych lub implantów, oraz systematyczną kontrolą stomatologiczną. W 10 proc. przypadków dochodzi do utraty implantów w ciągu trzech lat od radioterapii.[10]
Chorzy po zakończeniu leczenia radykalnego powinni być poddani systematycznej obserwacji, ponieważ u co piątego pacjenta dochodzi do wznowy procesu nowotworowego. 76 proc. przypadków nawrotów diagnozowanych jest w ciągu dwóch lat, a kolejne 11 proc. w trzecim roku od zakończenia leczenia. Przez pierwsze dwa lata zaleca się prowadzenie wizyt kontrolnych co trzy miesiące, a następnie co sześć miesięcy przez 3-5 lat. Poza oceną kliniczną i wykluczeniem objawów chorobowych nie należy pominąć oceny chorego dotyczącej jakości życia. Po pięciu latach zaleca się przeprowadzić dokładne badanie kliniczne, jak również ocenę obrazową w badaniach CT lub MR w celu wykluczenia nowego ogniska nowotworu. U 39 proc. chorych przebiega on bezobjawowo.[10]