Powikłania i ich leczenie
Protekcja płodności u mężczyzn dotkniętych chorobą nowotworową
Lek. med. Jan Karol Wolski

Wszystkie terapie onkologiczne, poza założonym osiągnięciem celowanego efektu leczenia danej choroby nowotworowej,...
Demografia mężczyzn chorych onkologicznie
Wedlug danych Krajowego Rejestru Nowotworów Zakładu Prewencji i Epidemiologii Nowotworów Centrum Onkologii w Warszawie[1] w 2010 roku w Polsce zanotowano w populacji mężczyzn 70 024 nowe zachorowania oraz 51 817 zgonów na nowotwory złośliwe. W przedziale wiekowym 20-44 lata, zwyczajowo traktowanym jako związany z prokreacją, były to odpowiednio grupy 3457 i 1184 pacjentów. Obserwowane w ostatnich latach zmiany obyczajowei Epidemiologii Nowotworów Centrum Onkologii w Warszawie[1] w 2010 roku w Polsce zanotowano w populacji mężczyzn 70 024 nowe zachorowania oraz 51 817 zgonów na nowotwory złośliwe. W przedziale wiekowym 20-44 lata, zwyczajowo traktowanym jako związany z prokreacją, były to odpowiednio grupy 3457 i 1184 pacjentów. Obserwowane w ostatnich latach zmiany obyczajowe, nie tylko w polskim społeczeństwie, indukuje zjawisko tzw. późnego ojcostwa (ang. late paternity). Coraz starsza populacja mężczyzn chce mieć jeszcze swoje dzieci w drugim lub nawet trzecim związku.
Występujące zwykle w tej grupie wiekowej różne choroby (układu sercowo-naczyniowego, cukrzyca, hypogonadyzm itd.) w sposób zrozumiały ograniczają potencjał osobniczej płodności, a wzrastająca zachorowalność na choroby nowotworowe dodatkowo wzmacnia ten efekt. Cytując wspomniany rejestr COI, w grupie 45-64 lata zanotowano 28 282 nowe zachorowania i 18 764 zgony.
Postęp onkologii wieku rozwojowego umożliwia przeżycie coraz większej grupy małych pacjentów, która wchodząc w wiek dorosły także chce mieć własne dzieci.
Według badań w USA corocznie ponad 20 tys. dzieci jest poddawanych terapiom onkologicznym z różnych powodów,[2] przeżywalność powyżej pięciu lat jest zdecydowanie lepsza w grupie prepubertalnej: 75 proc. poniżej 15. r.ż. versus 61 proc. w grupie 15-44 lata.[3]
Już pod koniec XX wieku prognozowano, że w 2010 roku 1/250 mężczyzn w okresie reprodukcyjnym będzie obciążona onkologicznym wywiadem z okresu dzieciństwa.[4] Dane National Cancer Institute (www.cancer.gov) z 2003 roku mówią, że 3,5 proc. populacji w USA to pacjenci po leczeniu choroby nowotworowej. W Polsce liczba dziecięcych pacjentów (0-19 r.ż.) zgłaszanych do rejestru w COI wyniosła w 2010 roku 563 zachorowania i 146 zgonów.[1] Z powyższych danych wynika, że liczebność polskiej populacji mężczyzn chorych na różne choroby onkologiczne i potencjalnie zainteresowanych rozrodem może teoretycznie nawet sięgać 32,5 tys. pacjentów rocznie.
Potrzeba ojcostwa jest podstawową cechą emocjonalną większości mężczyzn. Brak możliwości poczęcia naturalnego jest obecnie problemem u co 5-6 pary na świecie, gdzie udział czynnika męskiego oceniany jest na 50 proc. Wiele chorób upośledza płodność, ale szczególnie choroby nowotworowe i ich leczenie powodują często nieodwracalne zmiany w gonadzie męskiej, co ostatecznie skutkuje bezpłodnością. Zadaniem każdego lekarza mającego pod opieką chorego onkologicznego w okresie rozrodczym jest skierowanie go do ośrodka zajmującego się protekcją płodności.
Jakkolwiek termin płodności u chorych onkologicznych (ang. oncofertility) został wymyślony w USA całkiem niedawno, bo w 2006 roku, to zwrócono uwagę na ten problem znacznie wcześniej. W 1971 roku, decyzją prezydenta Stanów Zjednoczonych R. Nixona, powołano do życia Narodowy Instytut Raka (National Cancer Institute). Rozpoczęto wówczas swoistą wojnę z rakiem (ang. war on cancer), która miała na celu poprawę wyników leczenia i przeżywalności Amerykanów dotkniętych schorzeniami nowotworowymi. Skutkowało to wzrastającą liczbą pacjentów, którzy problem onkologiczny mieli już szczęśliwie za sobą, a w związku z dobrym stanem zdrowia prezentowali silne potrzeby w sferze realizacji seksualności i pragnienia rodzicielstwa.[3,5] Z drugiej strony mieliśmy spektakularne sukcesy medycyny rozrodu: 1978 – zapłodnienie pozaustrojowe IVF (in vitro, Robert Edwards, Patrick Steptoe – Nagroda Nobla 2010); 1992 – bezpośrednie wstrzyknięcie plemnika do cytoplazmy komórki jajowej ICSI (Intracytoplasmic Sperm Injection – JP Palermo), umożliwiały uzyskanie ciąży i urodzenie dziecka z użyciem pojedynczych komórek generatywnych zarówno kobiety, jak i przede wszystkim mężczyzny.[6] Ponadto, osiągnięcia w kriokonserwacji w ciekłym azocie (minus 196ºC) ludzkich komórek generatywnych, oparte na doświadczeniach Polge’a jeszcze z połowy XX wieku, skutkowały użyciem rozmrożonych plemników w rozrodzie.[7,8] Pacjenci onkologiczni otrzymali zatem do dyspozycji bardzo dobre, sprawdzone w klinice narzędzia do wykreowania ciąży.
W celu połączenia oczekiwań pacjentów z możliwościami współczesnej medycyny rozrodu powstało w USA Oncofertility Consortium – płaszczyzna współpracy pomiędzy onkologami, lekarzami medycyny rozrodu, biologami i pacjentami, ukierunkowane przede wszystkim na młodych pacjentów w okresie prokreacyjnym. Sztandarową postacią tej grupy jest prof. Teresa K. Woodruff, ginekolog z Uniwersytetu w Chicago, USA.[3] Od lat prowadzi wielopłaszczyznowe działania, mające umożliwić jak największej grupie młodych ludzi z wywiadem onkologicznym zostanie biologicznymi rodzicami. Jest współautorką książki (2007) po raz pierwszy tak kompleksowo traktującej to zagadnienie.
Wpływ choroby nowotworowej i terapii na płodność mężczyzny
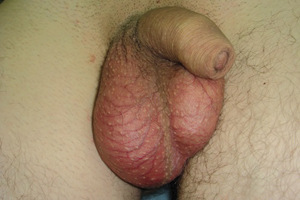
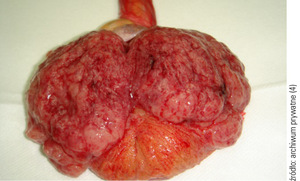
W powszechnej opinii, także lekarzy, za modelową chorobę uszkadzającą płodność mężczyzny uważany jest nowotwór jądra. (fot. 1, 2). Wynika to m.in. z faktu, że ta choroba występuje przede wszystkim w przedziale wieku 20-40 lat, a więc w okresie uważanym za najlepszy czas prokreacyjny. Jednak wszystkie terapie onkologiczne, poza założonym osiągnięciem celowanego efektu leczenia danej choroby nowotworowej, związane są z niekorzystnymi działaniami niepożądanymi na praktycznie wszystkie narządy. Szczególnie obciążone są gonady, w których elementy generatywne są szczególnie wrażliwe na leczenie przeciwnowotworowe.[9]
Lista leków onkologicznych powodujących uszkodzenie nasienia (azoospermię lub zaawansowaną oligoastenoteratozoospermię) jest długa.[9] Inne terapie onkologiczne, głównie radioterapia, również mają niekorzystny wpływ na spermatogenezę. Np. dawka 2-3 Gy na okolicę jądra powoduje przedłużoną azoospermię nawet do 30 miesięcy, a > 4 Gy na co najmniej 5 lat.[10] Stąd też towarzystwa naukowe, zgodnie z intencją środowisk medycznych i pacjenckich tworzących Oncofertility Consortium, stworzyły wytyczne i zalecenia dotyczące chronienia płodności chorych onkologicznych. W 2013 roku ASCO (American Society of Clinical Oncology) wydało nowelizację wytycznych z 2006 roku, w których nakłada na lekarzy włączonych w jakąkolwiek fazę leczenia (onkologom klinicznym, radioterapeutom, ginekologom onkologicznym, urologom, hematologom, onkologom pediatrycznym, chirurgom) obowiązek informowania pacjentów pediatrycznych i dorosłych leczonych z powodu raka i podejmowania działań służących protekcji ich płodności.[9] Europejskie Towarzystwo Urologiczne, którego nowelizowane co roku wytyczne (EAU Guidelines) w całości przejęło Polskie Towarzystwo Urologiczne, również zaleca, żeby wszystkim pacjentom przed chirurgiczną interwencją oraz chemio- i radioterapią zaproponować ochronę płodności (poziom A rekomendacji).[11]
Metody protekcji płodności męskiej
Pojęcie protekcji płodności mężczyzn dotkniętych chorobą nowotworową w chwili obecnej rozumiane jest jako zachowanie komórek generatywnych (plemników) pacjenta na potrzeby przyszłego rozrodu. Przed erą IVF (1978) była to przede wszystkim kriokonserwacja nasienia w ciekłym azocie, z intencją późniejszego użycia w protokole inseminacji domacicznej. Mrożenie odbywa się przy użyciu specjalnego medium zapobiegającego uszkodzeniu komórek przez kryształy wewnątrz- i zewnątrzkomórkowe, wytrącające się w trakcie procesu schładzania. Próbki są umieszczane w szklanych słomkach 300 μl. Sam proces schładzania jest powolny i odbywa się w dedykowanych automatycznych urządzeniach w tempie 8-21º C/min, do temperatury ciekłego azotu (minus 196ºC). Przechowywanie zamrożonych próbek w tzw. banku nasienia, który jest w istocie bankiem tkanek, odbywa się w specjalnych tankach i może trwać wiele lat. W literaturze opisano przypadek urodzenia się dziecka poczętego z rozmrożonych plemników po 21 latach.[12] W Polsce także przeprowadzano procedury IVF z plemnikami długo mrożonymi. Przykładem może być chory z nienasieniakiem jądra, u którego przeprowadzano kriokonserwację w 1992 roku – w okresie 2002-2010 urodziło się troje zdrowych dzieci, ostatnie poczęcie – plemnikami rozmrożonymi po 18 latach (Novum, Warszawa). Obecnie można już przechowywać same plemniki, pozyskane z nasienia lub z jądra drogą biopsji[7,10], które są używane w protokołach zapłodnienia pozaustrojowego IVF-ICSI. Przed wszczęciem procedur krioprotekcji należy dokładnie wyjaśnić pacjentowi i jego żonie (partnerce) zasady i cel postępowania, uzyskać świadomą zgodę, bądź rezygnację.
Przed mrożeniem nasienia należy ocenić je w oparciu o wytyczne Światowej Organizacji Zdrowia (WHO), ostatnia nowela w 2010 roku.[13] Aktualnie punktem odniesienia są wartości referencyjne: ilość, co najmniej 15 mln plemników/1 mL nasienia, ruch postępowy ≥ 32 proc. i prawidłowa budowa ≥ 4 proc.