Aktualne poglądy
Znaczenie patofizjologiczne i kliniczne związanego z TNF czynnika indukującego apoptozę (TRAIL) i jego receptorów
Dr hab. med. Leszek Gottwald
Ostatnie lata przyniosły znaczny postęp w badaniach nad molekularnymi i immunologicznymi aspektami karcynogenezy. Nadal trwają poszukiwania kolejnych parametrów, które z większą precyzją charakteryzowałyby nowotwory i pomagałyby określać rokowanie u chorych. Jednym z nowych parametrów, który znajduje się w kręgu zainteresowań badaczy, jest związany z czynnikiem martwicy nowotworu ligand indukujący apoptozę (tumor necrosis factor-related apoptosis-inducing ligand – TRAIL).
APOPTOZA
Apoptoza, nazywana również programowaną śmiercią komórki, jest procesem fizjologicznym uwarunkowanym genetycznie, polegającym na zmianach biochemicznych i morfologicznych komórek w efekcie proteolitycznej i nukleolitycznej degradacji ich składników, co w konsekwencji prowadzi do śmierci tych komórek.[1-3] W warunkach fizjologicznych prawidłowo przebiegająca apoptoza jest niezbędna do utrzymania prawidłowej homeostazy tkankowej.[1] Jej zaburzenia odgrywają istotną rolę w powstawaniu oraz progresji nowotworów, prowadząc do nieprawidłowego zwiększania się żywotności komórek, wydłużania ich życia i utrwalania już zaistniałych mutacji.[2,4] Apoptoza może być inicjowana dwiema drogami: wewnątrzkomórkową i zewnątrzkomórkową, które nierzadko ze sobą współwystępują.[2,5]
Droga wewnątrzpochodna apoptozy, związana z mitochondriami i z aktywacją genów rodziny bcl-2, jest typową reakcją komórki na uszkodzenie DNA lub inne bodźce wewnątrzkomórkowe.[2,4] W ten sposób przebiega zależna od genu p53 apoptoza komórkowa będąca skutkiem chemioterapii i radioterapii.[1,2,4,6] Wiele nowotworów unika jednak apoptozy wewnątrzpochodnej na drodze mutacji i dezaktywacji genu p53.[4]
W mechanizmie zewnątrzpochodnym apoptoza jest indukowana w sposób niezależny od genu p53, poprzez przyłączenie się ligandu do tzw. receptorów śmierci.[4,6] W zainicjowaniu tego procesu mają udział komórki immunokompetentne. Mogą one działać przez uwolnienie perforyn i granzymów lub na drodze interakcji z ligandami rodziny czynnika martwicy nowotworu (tumor necrosis factor – TNF): TNF-α, FasL (CD95L) i TRAIL, które są związane z „receptorami śmierci” na komórkach docelowych.[1-4] W efekcie pobudzenia „receptorów śmierci” dochodzi do kaskady zdarzeń komórkowych prowadzących do zmniejszania się komórki, rozpadu jądra i powstania ciałek apoptotycznych, usuwanych następnie przez inne komórki na drodze fagocytozy.[2,4,6]
LIGAND TRAIL
Do rodziny TNF należy TRAIL – białko błonowe typu II, zbudowane z 281 aminokwasów, opisane po raz pierwszy w 1995 roku przez Wiley i wsp.[7] TRAIL jest kodowany przez gen zlokalizowany na chromosomie 3, składający się z pięciu egzonów i czterech intronów.[7] Wykazuje on sekwencje homologiczne z innymi białkami rodziny TNF, jak Fas (CD95) i RNF, odpowiednio w 28 proc. i 33 proc.[7] Ligand TRAIL występujący w postaci rozpuszczalnej ma masę 20 kDa, natomiast w formie związanej z powierzchnią komórek immunokompetentnych, takich jak komórki dendrytyczne, makrofagi, limfocyty T i komórki NK, masę 33 kDa.[8,9] Ligand TRAIL i jego receptory są obecne w wielu prawidłowych tkankach organizmu człowieka.[7,8,10]
W przeciwieństwie do innych ligandów, jak TNF-α czy FasL, których pobudzenie jest toksyczne dla prawidłowych komórek organizmu, TRAIL ma zdolność indukowania apoptozy w komórkach nowotworowych, nie wykazując jednocześnie cytotoksyczności w stosunku do komórek prawidłowych, co potwierdzono w badaniach in vitro oraz in vivo.[3,7,8,11-13] W wywołaniu apoptozy indukowanej przez TRAIL w komórkach nowotworów mogą pomagać czynniki chemiczne i fizyczne działające w mechanizmie wewnątrzpochodnym.[3,14-16] Czynnikiem przeciwdziałającym apoptozie indukowanej przez TRAIL jest natomiast niedotlenienie, obecne często w centralnych fragmentach szybko rosnących nowotworów.[3] Obserwacja, że TRAIL selektywnie indukuje apoptozę jedynie w komórkach nowotworowych, nie powodując podobnego zjawiska w komórkach niezmienionych nowotworowo, stała się podstawą do licznych opracowań naukowych.[12,13,17-21]
RECEPTORY DLA LIGANDU TRAIL
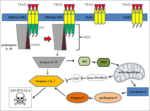
Ligand TRAIL działa poprzez cztery receptory TRAIL-R1 (DR4), TRAIL-R2 (DR5), TRAIL-R3 (DcR1/TRID/LIT) oraz TRAIL-R4 (DcR2/TRUNDD) znajdujące się na powierzchni komórek. Piątym receptorem jest rozpuszczalna osteoprotegryna (OPG), a połączenie z nią TRAIL nie wywołuje apoptozy.[9-11,21-25] Wszystkie receptory komórkowe dla TRAIL mają sekwencje homologiczne w swojej domenie zewnątrzkomórkowej. Wewnątrzkomórkowe domeny receptorów DR4 i DR5 po połączeniu receptora z ligandem pełnią podstawową rolę dla zapoczątkowania apoptozy.[8,21-25] Potwierdzono wysokie podobieństwo sekwencji receptorów DR4 i DR5 i różnice w termodynamice połączeń obu tych receptorów z ligandem TRAIL.[25]
Obecnie uważa się, że pobudzenie „receptorów śmierci” DR4 i DR5 powoduje ich oligomeryzację i indukuje apoptozę poprzez wewnątrzkomórkową domenę śmierci (death domain – DD). Wskutek połączenia DD z białkiem adaptorowym FADD (Fas-associated death domain) oraz z cytoplazmatyczną prokaspazą 8 powstaje kompleks DISC (death inducing signaling complex).[1,2,4,8,24] Połączenie DD z białkiem adaptorowym FADD może również aktywować prokaspazę 10, która prawdopodobnie wpływa na efekt proliferacyjny „receptorów śmierci”.[19] W niektórych komórkach już sama aktywacja kaspazy 8 jest wystarczająca do dalszego przebiegu apoptozy, w części komórek niezbędna jest również aktywacja drogi wewnątrzpochodnej. Aktywacja prokaspazy 8 prowadzi do aktywacji kaspazy 3, wiodąc w konsekwencji do wyzwolenia kaskady procesów wewnątrzkomórkowych prowadzących do oddzielenia się komórki od innych komórek, utraty wody i jej obkurczenia się.[1,8,9,21,26] Na różnych etapach dochodzi do aktywacji kaspazy 6 i 9 oraz innych substancji (ryc. 1).[2,8,9,26]
Ekspresję obu receptorów proapoptotycznych, tj. DR4 i DR5, wykazano w wielu lokalizacjach, w tym w leukocytach obwodowych, hepatocytach, neuronach, kanalikach krętych nerki, komórkach mięśnia sercowego, komórkach nabłonka jelitowego, nabłonku oskrzeli, komórkach przegród pęcherzyków płucnych, komórkach Leydiga, endometrium, a także w komórkach zarodkowych.[10,27-29] Ekspresję DR4 bez obecności ekspresji DR5 potwierdzono w nabłonku dróg żółciowych, a obecność DR5 bez obecności DR4 zaobserwowano w nabłonku naczyń mózgowych, w komórkach pętli Henlego, w blaszce właściwej błony śluzowej jelit i w nabłonku naczyń oskrzelowych.[10]
Przyłączenie się ligandu TRAIL do receptorów DcR1 i DcR2 nieposiadających domen cytoplazmatycznych, w przeciwieństwie do pobudzenia receptorów DR4 i DR5, nie prowadzi do apoptozy.[8,11] Dochodzi jedynie do związania cząsteczek ligandu, pośrednio więc do zmniejszenia wysycenia ligandem receptorów DR4 i DR5 na drodze konkurencji i w efekcie do przeciwdziałania apoptozie.[23] Jedna z koncepcji zakłada, że przyczyną, dla której ligand TRAIL nie powoduje apoptozy w prawidłowych komórkach organizmu, jest proporcjonalnie wysoka ekspresja na ich powierzchni „fałszywych” receptorów, tj. DcR1 i DcR2 („receptory ochronne”).[12] Wyniki badań ostatnich lat pokazują jednak, że nie jest to jedyny mechanizm wyjaśniający zjawisko oporności prawidłowych komórek na apoptozę indukowaną przez TRAIL.[17,21,30,31]
Obecność „receptorów ochronnych” DcR1 i DcR2 została potwierdzona w:
- hepatocytach,
- komórkach dróg żółciowych,
- nabłonku jelita grubego,
- neuronach,
- endometrium,
- komórkach mięśnia sercowego,
- komórkach zarodkowych,
- komórkach Leydiga.[10,27,32,33]
Ekspresję DcR2 przy braku ekspresji DcR1 znaleziono w:
- kanalikach krętych nerki,
- komórkach nabłonka jelitowego,
- komórkach krypt jelitowych,
- nabłonku oskrzeli,
- przegrodach między pęcherzykami płucnymi,
- nabłonku naczyń krwionośnych płuc.[10,27]
Ekspresję DcR1 bez obecności DcR2 stwierdzono natomiast w: