Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
- nabłonku naczyniowym w mózgu,
- sercu.[10]
LIGAND TRAIL JAKO POTENCJALNY ELEMENT W LECZENIU PRZECIWNOWOTWOROWYM
W ostatnich latach coraz częściej wskazuje się na rolę TRAIL jako cząsteczki efektorowej w zabijaniu komórek nowotworu złośliwego i jako potencjalnego narzędzia w leczeniu przeciwnowotworowym.[8,34] Badania fazy przedklinicznej, a także badania kliniczne z zastosowaniem rekombinowanego ludzkiego ligandu TRAIL (recombinant human TRAWL – rhTRAIL) oraz agonistów receptora dla TRAIL w licznych nowotworach wykazały korzystny efekt przeciwnowotworowy takiego postępowania.[5,9] Potencjał terapeutyczny rozpuszczalnego rekombinowanego TRAIL potwierdzono m.in. w:
- płaskonabłonkowym raku głowy i szyi,
- raku piersi,
- raku płuc,
- raku jelita grubego,
- raku odbytnicy,
- raku trzustki,
- raku nerki,
- raku tarczycy,
- raku endometrium,
- raku gruczołu krokowego,
- glejakach,
- szpiczaku mnogim,
- białaczkach.[16,20,21,34,35]
W piśmiennictwie spotyka się jednak także doniesienia, które nie potwierdzają tej zależności, wskazując na oporność niektórych nowotworów na TRAIL, w tym części linii raka piersi, raka płuc (NSCLC), raka nerki, nowotworów układu krwiotwórczego (przewlekła białaczka limfocytarna) i guzów ośrodkowego układu nerwowego (niektóre glejaki, oponiaki, rdzeniak zarodkowy).[5,30,35-37]
Badania ostatnich lat pokazują, że stosując odpowiednie chemioterapeutyki, można „uwrażliwić” na TRAIL komórki nowotworowe pierwotnie na niego niewrażliwe.[9,16,18,21,36,38,39] Zjawisko takie zaobserwowano, m.in. stosując sorafemib w badaniach nad rakiem endometrium.[15] Podobne wyniki uzyskano w badaniach nad rakiem jajnika i szyjki macicy oraz w nowotworach złośliwych w innych lokalizacjach.[12,15,40,41]
Są także prowadzone badania w celu wykorzystania rekombinowanego ligandu TRAIL jako radiouczulacza u chorych poddawanych radioterapii w celu zwiększenia promienioczułości nowotworu.[14] W badaniach in vitro stwierdzono bowiem zwiększenie promienioczułości w pierwotnie niewrażliwych na radioterapię komórkach HeLa raka szyjki macicy oraz raka piersi, płuca, jelita grubego, a także nowotworu głowy i szyi, gdy pobudzono ich proapoptotyczne receptory dla TRAIL.[42,43]
Możliwości i warunki do zastosowania ligandu TRAIL w praktyce klinicznej powinny być jednak rozpatrywane ostrożnie, ze względu na prawdopodobne niekorzystne działanie na ludzkie hepatocyty, szczególnie u pacjentów z zaburzeniami funkcji wątroby.[16,44,45]
ROZMIESZCZENIE I MOŻLIWE ZNACZENIE KLINICZNE RECEPTORÓW DLA TRAIL W NOWOTWORACH ZŁOŚLIWYCH
Większość opracowań dotyczących receptorów dla ligandu TRAIL w nowotworach dotyczy ich ekspresji cytoplazmatycznej. Opisano ją w wielu liniach komórkowych nowotworów in vitro, ale także w tkankach nowotworowych in vivo. Ekspresję cytoplazmatyczną DR4 i DR5 stwierdzono w:
- pierwotnych i przerzutowych guzach mózgu,
- białaczkach,
- czerniaku skóry,
- raku płuc,
- raku piersi,
- raku głowy i szyi,
- raku przełyku,
- raku jelita grubego,
- raku odbytnicy,
- raku trzustki,
- raku nerki,
- raku pęcherza moczowego,
- raku szyjki macicy,
- raku jajnika.[27,46-50]
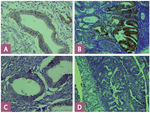
Ryc. 2. A – obecna ekspresja błonowa DR4 w prawidłowym endometrium (powiększenie 400 ×); B – obecna ekspresja błonowa DR4 w raku endometrium (powiększenie 400 ×); C – obecna ekspresja błonowa DR5 w prawidłowym endometrium (powiększenie 400 ×); D – brak ekspresji błonowej DR5 w raku endometrium (powiększenie 400 ×).
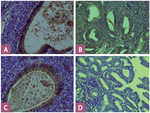
Ryc. 3. A – obecna ekspresja błonowa DcR1 w prawidłowym endometrium (powiększenie 400 ×); B – obecna ekspresja błonowa DcR1 w raku endometrium (powiększenie 400 ×); C – obecna ekspresja błonowa DcR2 w prawidłowym endometrium (powiększenie 400 ×); D – brak ekspresji błonowej DcR2 w raku endometrium (powiększenie 400 ×).
Wskazuje się na fakt, że występowanie błonowej ekspresji DR4 i DR 5 nie jest częste w przypadku ich wysokiej ekspresji cytoplazmatycznej. Taką właśnie zależność opisali Ganten i wsp. w raku piersi oraz Younes i wsp. w raku przełyku.[46,48] W badaniu Gottwalda i wsp. błonową ekspresję DR4 i DR5 w gruczolakoraku endometrioidalnym endometrium obserwowano rzadko, odpowiednio u 12 proc. i 4 proc. chorych.[29] Podobnie niskie odsetki przypadków wykazujących ekspresję błonową receptorów DR4 i DR5 opisano już wcześniej w rakach piersi i przełyku.[46,48] Istnieje wiele doniesień dotyczących występowania „receptorów ochronnych” dla ligandu TRAIL w liniach komórkowych nowotworów in vitro. Ich wyniki nie są jednoznaczne. Analizując błonową ekspresję DcR1 i DcR2 w liniach Colo 205 and Caco-2 ludzkiego raka okrężnicy, Sträter i wsp. w większości przypadków nie zaobserwowali ekspresji żadnego z tych receptorów.[51] Tomek i wsp. w badaniu metodą RT-PCR, badając sześć linii komórkowych raka jajnika, uzyskali pozytywne wyniki dla wszystkich ocenianych linii komórkowych względem receptorów DcR1 i DcR2 i nie stwierdzili korelacji obecności ekspresji DcR1 i DcR2 z podatnością lub opornością na działanie ligandu TRAIL.[52] Z kolei Davidovich i wsp., prowadząc badania na linii komórkowej ludzkiego włókniakomięsaka HT1080/E14, zaobserwowali zarówno obecność komórek wykazujących ekspresję obu receptorów, jak i komórek niewykazujących tej ekspresji. Komórki oporne na działanie ligandu TRAIL cechowały się wyższym poziomem ekspresji DcR1 w porównaniu z komórkami podatnymi na działanie TRAIL.[53]
W badaniach prowadzonych na tkankach nowotworowych również oceniano ekspresję „receptorów ochronnych” dla ligandu TRAIL. Frank i wsp. ocenili ekspresję cytoplazmatyczną DcR1 i DcR2 w 19 pierwotnych i 11 przerzutowych guzach mózgu, stwierdzając obecność DcR1 odpowiednio w 18/19 i 9/11 przypadków, a DcR2 w 6/19 i 1/11 przypadków.[27] W tkankach raka endometrium cytoplazmatyczna ekspresja DcR1, bez jednoczesnej oceny pozostałych receptorów dla TRAIL, została opisana przez Tarragonę i wsp. w 98 proc. z analizowanych 62 przypadków raka endometrium.[32] W badaniu Gottwalda i wsp. błonowa ekspresja DcR1 i DcR2 była obecna odpowiednio u 27,3 proc. i u 18,7 proc. chorych na raka endometrium.[33] Połączenie wyników obu tych badań daje obraz rzeczywistego rozkładu „receptorów ochronnych” dla ligandu TRAIL w komórkach raka endometrium.
Z klinicznego punktu widzenia znajomość występowania i rozmieszczenia receptorów dla TRAIL w komórkach i tkankach nowotworów może okazać się istotna. Pojawiły się bowiem doniesienia o występowaniu korelacji wielkości ekspresji cytoplazmatycznej obydwu „receptorów śmierci” oraz „receptorów ochronnych” dla ligandu TRAIL ze zróżnicowaniem histologicznym i zawansowaniem nowotworów.[46] Koksal i wsp. w raku gruczołu krokowego stwierdzili również dodatnią korelację ekspresji DcR2 z punktacją w skali Gleasona oraz ze stężeniem PSA.[54] Nie wszyscy autorzy potwierdzają jednak występowanie podobnych zależności. Koornstra i wsp. nie zaobserwowali zależności pomiędzy ekspresją cytoplazmatyczną DR4 i DR5 a zróżnicowaniem histologicznym i zaawansowaniem raka okrężnicy.[27] Z kolei u chorych z rakiem endometrium Tarragona i wsp. opisali brak różnic w obecności i wielkości ekspresji DcR1 w zależności od typu i zróżnicowania histologicznego oraz zaawansowania nowotworu.[32]
W piśmiennictwie pojawiają się również prace mówiące o możliwym znaczeniu prognostycznym ekspresji receptorów dla TRAIL w chorobie nowotworowej. Poglądy badaczy w tym zakresie różnią się jednak znacząco. Li i wsp. w dziesięcioletniej obserwacji opisali istotnie dłuższe przeżycie bez wznowy u chorych z rakiem pęcherza moczowego z wysoką ekspresją DR4 i DR5 w porównaniu z chorymi z niską ekspresją obydwu tych receptorów.[47] W raku gruczołu krokowego Koksal i wsp. opisali zależność pomiędzy wysoką ekspresją DcR2 a wystąpieniem wznowy i długością przeżycia.[54] Z drugiej jednak strony Zhuang i wsp. nie stwierdzili zależności cytoplazmatycznej ekspresji DcR1 i DcR2 z rokowaniem w chorobie nowotworowej.[55]
PODSUMOWANIE
1. Chociaż funkcje i znaczenie ligandu TRAIL, jego „rceptorów śmierci” i „receptorów ochronnych” oraz osteoprotegryny w prawidłowych i zmienionych nowotworowo komórkach są jest już dość dobrze zdefiniowane, to jednak wymagają dalszych badań.
2. Heterogenność receptorów sugeruje złożoność mechanizmów związanych z ich biologiczną funkcją, a wielkość ich ekspresji nie musi korelować z odpowiedzią na ligand TRAIL.
3. Należy mieć nadzieję, że dokonujący się na naszych oczach olbrzymi postęp pozwoli w niedługim czasie jednoznacznie określić możliwości zastosowania ligandu TRAIL i jego receptorów w praktyce klinicznej.