Dylematy kliniczne
Guzek, obrzęk, deformacja piersi – problem dla hematologa?
Lek. Jakub Miszczyk
Lek. Michał Charytonowicz
Dr n. med. Daria Charytonowicz
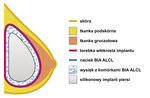
Anaplastyczny chłoniak wielkokomórkowy związany z implantami piersi (BIA ALCL) należy do pierwotnych chłoniaków piersi o punkcie wyjścia w obrębie torebki włóknistej implantu piersi. Dotychczas na świecie opisano ok. 200 pacjentek z tym schorzeniem. Towarzyszy jedynie implantom o powierzchni teksturowanej, objawia się najczęściej jako późny seromat wokół implantu lub masa w obrębie torebki włóknistej. Do postawienia diagnozy konieczne jest badanie immunohistochemiczne próbki płynu wysiękowego i wycinków torebki włóknistej implantu. U większości pacjentek naciek chłoniaka nie przekracza torebki włóknistej implantu i w takich przypadkach wystarczającym leczeniem wydaje się usunięcie obydwu implantów wraz z torebkami włóknistymi, jednak w stadiach bardziej zaawansowanych konieczne jest leczenie uzupełniające. Ponad 90 proc. pacjentek przeżywa pięć lat od momentu rozpoznania.
Wyczuwalny guzek, obrzęk, deformacja piersi – te objawy kojarzone są głównie z rozrostami tkanki nabłonkowej gruczołu piersiowego. Leczenie tych nowotworów jest domeną chirurgów onkologicznych, onkologów klinicznych, radioterapeutów, ale czy powyższe objawy mogą sugerować konieczność konsultacji lekarza hematologa? Otóż tak – przedstawione odchylenia w badaniu przedmiotowym mogą być manifestacją opisanej niedawno jednostki chorobowej – anaplastycznego chłoniaka wielkokomórkowego związanego z implantami piersi (breast implant-associated anaplastic large cell lymphoma – BIA ALCL). Jest to problem nowy i dotychczas niedostatecznie poznany – pierwszy przypadek anaplastycznego chłoniaka wielkokomórkowego związanego z implantami piersi został opisany w 1997 roku w Stanach Zjednoczonych.[1] Wystąpił u pacjentki z implantami piersi o powierzchni teksturowanej, wypełnionymi solą fizjologiczną, manifestując się klinicznie jako 2-cm guzek w obrębie torebki włóknistej implantu. Od tego czasu w literaturze pojawiały się pojedyncze opisy przypadków klinicznych czy niewielkich grup pacjentek. Po 14 latach od pierwszego opisu przypadku, w 2011 roku amerykańska FDA wydała oficjalny komunikat, potwierdzający zwiększone ryzyko wystąpienia pierwotnego anaplastycznego chłoniaka wielkokomórkowego piersi u pacjentek z implantami piersi.[2]
Pierwotne chłoniaki piersi – podstawowe informacje
Anaplastyczny chłoniak wielkokomórkowy związany z implantami piersi należy do grupy chłoniaków nieziarniczych (non-Hodgkin’s lymphoma – NHL). Stanowią one zaledwie 0,01-0,5 proc. wszystkich złośliwych nowotworów piersi.[3] Wśród pierwotnych NHL piersi przeważają chłoniaki z limfocytów B, jak rozlany chłoniak z dużych komórek B czy pozawęzłowy chłoniak strefy brzeżnej.[4] Chłoniaki z limfocytów T, do których należy BIA ALCL, stanowią zaledwie ok. 10 proc. pierwotnych NHL piersi,[5] a sam ALCL stanowi ok. 3 proc. wszystkich NHL piersi.[6]
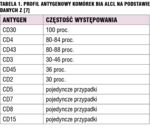
Clemens i wsp. zbadali profil antygenowy komórek BIA ALCL[7] (tabela 1). We wszystkich przypadkach mają one antygen powierzchniowy CD30, dodatkowo nie wykazują ekspresji kinazy ALK (anaplastic lymphoma kinase). Te dwie cechy stanowią zazwyczaj podstawę rozpoznania w diagnostyce cytologicznej. Laurent i wsp. przeprowadzili wnikliwą analizę komórek BIA ALCL, opracowując ich profil immunohistochemiczny oraz molekularny.[8] Komórki fenotypowo przypominają aktywowane limfocyty T cytotoksyczne: TIA-1+/−, granzym B+/−, perforyna+/−, jednak wykazano masywną utratę typowych antygenów – najczęściej CD3, CD5, CD7 oraz często brak ekspresji receptorów TCRββF1 i TCRγ. Wszystkie komórki miały antygen CD30, większość również CD4 (84 proc.) i CD43 (95 proc.). W dwóch przypadkach wykazano koekspresję antygenu CD4 i CD8, antygen CD56 był obecny w dwóch przypadkach. Antygeny CD45/LCA i BCL2 były zazwyczaj obecne, antygen CD15 wykazywał słabą ekspresję w 53 proc. przypadków. Antygeny CD20 i CD97a nie zostały wykryte w żadnym przypadku, w kilku przypadkach stwierdzono ekspresję białka PAX5. Ekspresja antygenu EMA oraz białka MUM1 występowała w większości przypadków. W jądrze komórkowym stwierdzono ekspresję białka pSTAT3, nie wykryto genów EBV w żadnym przypadku. Nie stwierdzono mutacji genu DUSP22, natomiast geny TCRG uległy rearanżacji we wszystkich przypadkach, geny TCRB – w 46 proc. przypadków. W dwóch przypadkach wykryto poliklonalną rearanżację genów IGH oraz IGK. Autorzy donoszą o kilku przypadkach, w których jednoznaczne postawienie rozpoznania BIA ALCL stanowiło znaczny problem kliniczny. W większości przypadków komórki mają fenotyp aktywowanych limfocytów T cytotoksycznych, jednak często obecna jest masywna utrata antygenów oraz brak ekspresji receptora TCR, co może utrudniać diagnostykę cytologiczną. Autorzy podkreślają, że niektóre komórki nowotworowe miały fenotyp „NK/T” z ekspresją antygenu CD56, jednakże we wszystkich badanych przypadkach wykluczono obecność w komórkach genów EBV, a wykrycie klonalnej rearanżacji genów receptora TCRγ umożliwiło odróżnienie BIA ALCL od pozawęzłowego chłoniaka z komórek NK/T typu nosowego. W niektórych przypadkach komórki BIA ALCL przypominały fenotypowo komórki chłoniaka Hodgkina. Oprócz utraty antygenów T-limfocytarnych wykazywały zmienną ekspresję antygenu CD15, w tym w dwóch przypadkach – jednocześnie ekspresję białka PAX5. Ten fenotyp spowodował błędne rozpoznanie klasycznego chłoniaka Hodgkina u jednej pacjentki. Przypadki te pokazują, że rozpoznanie BIA ALCL wymaga ścisłej korelacji obrazu klinicznego z wynikami badań immunohistochemicznych i molekularnych. Pod względem morfologicznym i cytologicznym komórki BIA ALCL są podobne do tych występujących w przypadkach układowego ALCL bez ekspresji kinazy ALK,[9] jednak postać związana z implantami piersi i układowa mają odmienny przebieg kliniczny i rokowanie – odsetek pięcioletnich przeżyć w pierwszej sięga 92 proc.,[10] natomiast w postaci układowej pięć lat przeżywa tylko 20-50 proc. chorych.[11]
Etiopatogeneza
BIA ALCL towarzyszy jedynie wszczepom o powierzchni teksturowanej. Może to być związane z bardziej nasilonym odczynem wytwórczym i reakcją zapalną niż w przypadku implantów o gładkiej powierzchni, jednak etiopatogeneza schorzenia nie została jeszcze wyjaśniona.[12] Możliwe, że przyczyną reakcji zapalnej i ekspansji klonalnej limfocytów T jest sam silikon lub inne substancje użyte do produkcji zewnętrznej powłoki implantu piersi, np. diaminotoluen.[6] Ostatnio postuluje się, że implanty teksturowane pełnią jedynie rolę biernego czynnika potencjalizującego, a prawdziwym czynnikiem etiologicznym BIA ALCL jest biofilm bakteryjny wokół implantu. Biofilm ten nie jest wykrywalny metodami tradycyjnej hodowli mikrobiologicznej. Teksturowanie powierzchni implantu zwiększa powierzchnię, na której może tworzyć się warstwa biofilmu, która jest odpowiedzialna za aktywację limfocytów T oraz odczyny wytwórcze, np. przykurcz torebkowy.[13] Następcza hiperplazja limfocytów T może prowadzić do rozwoju BIA ALCL. Przełomowa wydaje się praca Hu i wsp.,[14] którzy przy wykorzystaniu PCR wykazali różnice w składzie gatunkowym biofilmu wśród pacjentek z BIA ALCL v. grupa kontrolna kobiet z przykurczem torebkowym bez BIA ALCL. W grupie kobiet z BIA ALCL w biofilmie przeważały bakterie z gatunku Ralstonia, które mogą być czynnikiem etiologicznym BIA ALCL, podobnie jak Helicobacter pylori w przypadku chłoniaka MALT żołądka. Pewne nadzieje na dalsze badania daje wyprowadzenie linii komórkowej z komórek BIA ALCL (linia TLBR-1) i zakończone sukcesem przeszczepienie tych komórek myszy immunoniekompetentnej.[15]
Epidemiologia
Analiza epidemiologiczna tego nowego zjawiska opiera się jedynie na dostępnych danych literaturowych, nie opracowano do tej pory jednolitego systemu raportowania, a otrzymane wyniki mogą być znacznie niedoszacowane ze względu na wciąż niską świadomość problemu wśród lekarzy. W 2015 roku Brody zebrał 173 udokumentowane w literaturze przypadki BIA ALCL na świecie.[16] Na początku roku 2016 Clemens opublikował informacje na temat 37 nowych, niezgłoszonych wcześniej przypadków.[17] Dane amerykańskie wskazują na występowanie 0-10 nowych przypadków BIA ALCL rocznie w samych Stanach Zjednoczonych.[16] Według analizy epidemiologicznej przeprowadzonej w Holandii w 2008 roku ryzyko względne wystąpienia ALCL piersi wynosi ok. 18,2 (95 proc. CI: 2,1-156,8) po wszczepieniu implantów, jednak ryzyko bezwzględne nadal pozostaje bardzo niskie, rzędu 1-3 na milion kobiet z implantami piersi rocznie.[18] Nowsze dane amerykańskie z 2011 roku sugerują, że częstość występowania może być nieco wyższa i wynosić 6-12 zachorowań na milion kobiet z implantami piersi rocznie, jednak nadal są to jedynie zgrubne oszacowania.[12]
Obraz kliniczny
Co powinno skłonić lekarza do wdrożenia u pacjentki diagnostyki w kierunku BIA ALCL? Pewne wnioski można wyciągać na podstawie obrazu klinicznego wśród ok. 200 udokumentowanych przypadków. Wydaje się, że wszystkie dotychczasowe zachorowania dotyczą pacjentek z silikonowymi implantami piersi o powierzchni teksturowanej.[16,17] Dwa doniesienia o ALCL piersi u pacjentek z wszczepami o powierzchni gładkiej najprawdopodobniej dotyczą pierwotnego chłoniaka piersi o wątpliwym związku z implantami – u tych pacjentek ognisko chłoniaka zlokalizowane było w tkance gruczołowej piersi, a nie w torebce włóknistej implantu, jak ma to miejsce w BIA ALCL.[16] Zachorowania dotyczą zarówno pacjentek pierwotnie operowanych z powodów estetycznych (59 proc. przypadków), jak i rekonstrukcyjnych w przebiegu leczenia raka piersi (41 proc. przypadków).[19] Znaczenia prawdopodobnie nie ma wypełnienie implantu silikonowego – BIA ALCL zdiagnozowano u pacjentek z wszczepami wypełnionymi zarówno żelem silikonowym (42 proc. przypadków), jak i solą fizjologiczną (58 proc. przypadków).[20] Zachorowalność zdaje się nie zależeć od czasu upływającego od wszczepienia implantów – wahał się on między czterema miesiącami a aż 25 latami (mediana 9,3 roku),[16] średni wiek pacjentek w chwili diagnozy wynosił ok. 50 lat.[21] Ryzyko rozsiewu uogólnionego najprawdopodobniej nie zależy od czasu, jaki upłynął od pojawienia się objawów do wdrożeniu leczenia, w zebranych przypadkach czas ten wahał się od miesiąca do dwóch lat.[16] Ponad 80 proc. pacjentek zostało zdiagnozowanych w I stopniu zaawansowania klinicznego według klasyfikacji Ann Arbor,[10] opracowana została również propozycja klasyfikacji TNM dla BIA ALCL[17] (tabela 2). Głównym powodem zgłaszania się pacjentek do lekarza był obrzęk piersi, z miernie nasilonym dyskomfortem, bez wyraźnych objawów bólowych. Przyczyną objawów jest powstawanie seromatu – gromadzenie się wysięku surowiczego pod torebką włóknistą implantu (ryc. 1). Objętość wysięku wahała się pomiędzy 200 a 1000 ml.[19] Sporadycznie (dziewięć przypadków) pierwotnie wykrytą zmianą był guzek w obrębie torebki włóknistej implantu, któremu zawsze towarzyszył wysięk. W kilku przypadkach (sześć pacjentek) guzek będący pierwotnym ogniskiem chłoniaka wykryto przypadkowo podczas rewizji kieszeni implantu.[16] Średnica guzków wahała się od 4 mm do 10 cm (średnio 4,4 cm).[22] W pojedynczych przypadkach BIA ALCL objawiał się jako owrzodzenie piersi (trzy przypadki) czy lokalna limfadenopatia (trzy przypadki), co dalej prowadziło do wykrycia zmiany pierwotnej w torebce włóknistej implantu.[16] Podczas dalszej diagnostyki komórki nowotworowe znajdowane były jednocześnie w wysięku surowiczym i torebce włóknistej implantu, we wszystkich przypadkach wyniki wykonanych posiewów były negatywne.[16]

Tabela 2. Propozycja klasyfikacji TNM dla BIA ALCL oraz stopni zaawansowania w modyfikacji własnej na podstawie [17]
Stopień zaawansowania choroby w udokumentowanych przypadkach jest bardzo zróżnicowany – od jedynie pojedynczych komórek chłoniaka w aspiracie wysięku surowiczego bez cech zajęcia jakichkolwiek tkanek u pięciu pacjentek aż po gwałtownie postępujący rozwój rozsianej choroby opornej na leczenie, zakończony zgonem u 9 z 10 opisanych pacjentek.[23] Zmiany w większości przypadków nie przekraczały torebki włóknistej implantu, przerzuty miejscowe do pachowych i śródpiersiowych węzłów chłonnych wystąpiły u ośmiu pacjentek.[16] U jednej pacjentki zaobserwowano ośrodkowe porażenie nerwu twarzowego w przebiegu zajęcia ośrodkowego układu nerwowego przez naciek chłoniaka.[18] Objawy ogólne charakterystyczne dla chłoniaków, takie jak poty nocne, zmęczenie i utrata wagi, występowały jedynie u pięciu pacjentek.[16] Podnoszone są spekulacje istnienia związku agresywnego przebiegu choroby z manifestacją ogniska pierwotnego pod postacią guzka.[10] Nie zostały one jednoznacznie potwierdzone – w pracy Brody’ego jedynie u czterech z dziewięciu zmarłych pacjentek zmiana pierwotna miała charakter wykrywalnej palpacyjnie masy,[16] natomiast w publikacji Laurenta obecność wyczuwalnego guzka wiązała się z dwuletnim przeżyciem rzędu 52,5 proc. v. 100 proc. w grupie pacjentek z obecnością seromatu jako jedynej manifestacji klinicznej.[8]