Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Chirurgia onkologiczna
Rola chemioterapii w nowoczesnym leczeniu chorych na raka przełyku i raka żołądka
dr n. med. Paweł Nurzyński
prof. dr hab. n. med. Andrzej Deptała
Nowotwory nabłonkowe przełyku i żołądka to grupa schorzeń niejednorodna pod względem biologii, przebiegu klinicznego, rokowania oraz wyników leczenia. Chemioterapia odgrywa istotną rolę w skojarzonym leczeniu tego typu nowotworów.
Rak przełyku i rak połączenia przełykowo-żołądkowego
Łączne omówienie raka przełyku (EC – esophageal cancer) i raka połączenia przełykowo-żołądkowego (EJC – esophagogastric-junction cancer) jest skutkiem włączenia EJC do systemu AJCC/UICC (American Joint Committee on Cancer/Unio Internationalis Contra Cancrum) oceny zaawansowania klinicznego raka przełyku oraz leczenia chorych na EC i EJC tymi samymi protokołami terapeutycznymi w ramach prospektywnych randomizowanych badań klinicznych z losowym doborem chorych (tab. 1 i 2).
W Polsce w 2012 r. stwierdzono 1256 zgonów mężczyzn i 319 zgonów kobiet z powodu raka przełyku.1,2 Wyniki chirurgicznego leczenia tego nowotworu mimo postępu w chirurgii są w dalszym ciągu niezadowalające. Po radykalnej resekcji przełyku 5 lat przeżywa około 45% pacjentów z rakiem płaskonabłonkowym (SCC – squamous cell carcinoma) w II stopniu zaawansowania wg AJCC i 20% pacjentów w stopniu III oraz około 40% pacjentów z gruczolakorakiem (ADC – adenocarcinoma) w II stopniu i 19% w III stopniu zaawansowania wg AJCC.1,3 Z tego względu poprawy przeżycia chorych upatruje się w zastosowaniu okołooperacyjnej chemioterapii lub chemioradioterapii.
Przełomowe w leczeniu skojarzonym EC i EJC były wyniki randomizowanego prospektywnego badania III fazy z losowym doborem chorych – CROSS II.1,4 W badaniu poddano ostatecznej analizie 366 chorych na EC (76%) i EJC (24%), z których 75% (275) miało rozpoznanie ADC, 23% (84) SCC, a 2% (7) raka niezróżnicowanego wielkokomórkowego. Pacjentów z klinicznie ustalonym zaawansowaniem choroby jako T1N1 i T2-3/N0-1 (IIA, IIB i IIIA wg AJCC) przydzielono losowo do grupy z przedoperacyjną (neoadiuwantową) chemioradioterapią (paklitaksel + karboplatyna + 41,4 Gy w 23 frakcjach) z następową resekcją (ramię CTH-RTH-CH) lub do grupy leczonej wyłącznie chirurgicznie (ramię CH). Analiza zgodna z zaplanowanym leczeniem (ITT – intention-to-treat) wykazała, że w ramieniu CTH-RTH-CH mediana przeżycia całkowitego (OS – overall survival) była dwukrotnie większa niż w ramieniu CH i wyniosła 49,4 miesiąca w porównaniu z medianą 24 miesięcy u chorych leczonych wyłącznie chirurgicznie (p = 0,003; iloraz zagrożeń [HR – hazard ratio] 0,657; 95% CI 0,495-0,871). Dwa lata przeżyło 67% chorych w ramieniu CTH-RTH-CH i 47% w ramieniu CH. 5 lat przeżyło 50% chorych w ramieniu CTH-RTH-CH i 4% w ramieniu CH. Większą poprawę OS po zastosowaniu przedoperacyjnej radiochemioterapii uzyskano w grupie chorych z podtypem SCC (p = 0,011; skorygowany HR 0,422; 95% CI 0,226-0,788; skorygowany względem HR p = 0,007) niż w grupie pacjentów, u których rozpoznano ADC (p = 0,049; skorygowany HR 0,741; 95% CI 0,536-1,024; skorygowany względem HR p = 0,07). Resekcję chirurgiczną przeprowadzono u 94% chorych z ramienia CTH-RTH-CH i u 99% z ramienia CH (p = 0,01), jednakże wycięcie R0 udało się wykonać odpowiednio u 92% vs 69% (p <0,0001) chorych, a całkowitą odpowiedź patologiczną (ypT0N0) uzyskano u 29% i jedynie w ramieniu CTH-RTH-CH (u 23% z ADC i u 49% z SCC; p = 0,008). Leczenie było dobrze tolerowane, a poważne działania niepożądane związane z chemioradioterapią wystąpiły u kilku procent pacjentów (najczęstsze: leukopenia u 6%, małopłytkowość u 2%, jadłowstręt u 5%, męczliwość u 3%). Śmiertelność w okresie pooperacyjnym w czasie pobytu w szpitalu wyniosła 4% w każdym z ramion, a 30-dniowa 2% w ramieniu CTH-RTH-CH i 3% w ramieniu CH. Nieszczelność zespolenia wystąpiła odpowiednio u 22% chorych w ramieniu CTH-RTH-CH i 30% w ramieniu CH.1,4
W 2014 r. ten sam zespół badaczy dokonał analizy badań CROSS I i CROSS II (odpowiednio II i III fazy) pod kątem typów nawrotu operacyjnego EC/EJC w ramionach CTH-RTH-CH vs CH.1,5 418 chorych (75% z rozpoznaniem gruczolakoraka) poddano analizie, która wykazała, że zastosowanie przedoperacyjnej CTH-RTH zmniejszyło ogólną częstość nawrotu raka do 34% (z 58% w ramieniu CH) i częstość wznów miejscowych (lokoregionalnych) do 14% z 34% (p < 0,001), rozsiewu otrzewnowego do 4% z 14% (p <0,001), rozsiewu krwiopochodnego do 29% z 34% (p <0,025).1,4,5
Po opublikowaniu powyższej analizy do redakcji „Journal of Clinical Oncology” zaczęły napływać krytyczne listy, ponieważ inni badacze zauważyli błędy interpretacyjne, których dopuścili się autorzy badań CROSS. Najpoważniejsze wątpliwości mieli Smyth i wsp.1,6 Ich zastrzeżenia do badań CROSS były następujące: 1) nie uzyskano statystycznie znamiennego wydłużenia OS pod wpływem CTH-RTH u chorych z rozpoznaniem operacyjnego gruczolakoraka (75% chorych w badaniu CROSS; p = 0,07); 2) nie uzyskano statystycznie znamiennego wydłużenia OS pod wpływem CTH-RTH u chorych z klinicznymi cechami zajęcia węzłów chłonnych przed rozpoczęciem leczenia (65% chorych w badaniu CROSS; skorygowany HR 0,806; 95% CI 0,576-1,130; skorygowany względem HR p = 0,21); 3) chemioradioterapia nie spowodowała zmniejszenia ryzyka wystąpienia izolowanych przerzutów odległych; 4) nie przedstawiono analizy przerzutów odległych w korelacji z histologicznym typem nowotworu; 5) błędnie zaklasyfikowano przerzuty do węzłów chłonnych nadobojczykowych jako nawroty lokoregionalne, podczas gdy wg klasyfikacji AJCC1,3 są to przerzuty odległe (cecha M1). Smyth i wsp. podsumowali, że jedyną grupą, która odniosła rzeczywiste korzyści w przeżyciu po neoadiuwantowej CTH-RTH byli chorzy na operacyjnego raka płaskonabłonkowego z kliniczną cechą N0.1,6
W 2014 r. brytyjscy autorzy1,7 przeprowadzili analizę (na podstawie prospektywnie zebranych danych z lat 2000-2010) 584 resekcji z powodu gruczolakoraka EC i EJC, w której udowodnili zmniejszenie stopnia zaawansowania nowotworu (T/N downstaging) po chemioterapii neoadiuwantowej (ECF – epirubicyna + cisplatyna + fluorouracyl) z następową operacją. Taki sposób postępowania terapeutycznego statystycznie znamiennie poprawił przeżycie chorych (p <0,001) w porównaniu z osobami, u których nie uzyskano odpowiedzi na przedoperacyjną CTH. Zmniejszenie zaawansowania raka okazało się najsilniejszym niezależnym dodatnim czynnikiem predykcyjnym OS (HR 0,43; 95% CI 0,31-0,59). Ponadto wykazano, że u chorych odpowiadających redukcją zaawansowania nowotworu na przedoperacyjną chemioterapię, w porównaniu z chorymi, u których nie uzyskano odpowiedzi, obserwuje się zmniejszenie ryzyka nawrotu lokoregionalnego (odpowiednio 6% vs 13%; p = 0,030) i wznowy w postaci przerzutów odległych (odpowiednio 9% vs 29%; p = 0,027).1,7
Uważamy zatem, iż chorzy z operacyjnym płaskonabłonkowym rakiem przełyku w II i III stopniu klinicznego zaawansowania wg AJCC powinni być leczeni w sposób skojarzony, tj. chemioradioterapią przedoperacyjną (paklitaksel + karboplatyna + 41,4 Gy) z następową radykalną resekcją chirurgiczną. W przypadku pacjentów z operacyjnym gruczolakorakiem przełyku i połączenia przełykowo-żołądkowego o tym samym klinicznym zaawansowaniu choroby nie można jednoznacznie uznać przedoperacyjnej chemioradioterapii za optymalną strategię terapeutyczną, ponieważ zarówno badania CROSS, jak i wcześniejsze badanie Stahla i wsp.1,8 (różnice w OS były w nim nieznamienne statystycznie) nie dostarczyły przekonujących dowodów na jej potwierdzenie. Dlatego równorzędną alternatywą dla przedoperacyjnej chemioradioterapii u pacjentów z gruczolakorakiem przełyku i połączenia przełykowo-żołądkowego w II i III stopniu zaawansowania wg AJCC jest zastosowanie chemioterapii okołooperacyjnej takiej jak w raku żołądka.1
Rak żołądka
Rak żołądka (GC – gastric cancer) jest czwartym co do częstości zachorowania nowotworem na świecie, a drugim pod względem liczby zgonów.1,3 W Polsce mimo stałego spadku (od lat 70.) liczby zachorowań i zgonów z powodu raka żołądka w 2012 r. zmarło z powodu tego nowotworu aż 5317 osób (3475 mężczyzn i 1842 kobiety),1,2 co oznacza, że rak ten był zbyt późno rozpoznawany i większość chorych nie była kandydatami do leczenia z intencją wyleczenia.
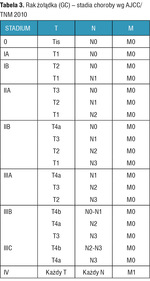
Leczenie wyłącznie chirurgiczne jest zarezerwowane dla wczesnych postaci GC (I stadium wg AJCC), a chorzy z operacyjnym rakiem miejscowo zaawansowanym (stadium II i wyższe wg AJCC, ale koniecznie bez przerzutów odległych – cecha M01,3) (tab. 3) mogą skorzystać z jednej z 3 opcji leczenia skojarzonego:
- chemioterapia okołooperacyjna (CTH-O)
- chemioterapia adiuwantowa (CHT-A)
- chemioradioterapia adiuwantowa (CTH/RTH-A).
Pierwsza opcja jest najczęściej wybierana w Europie, druga w Japonii, Korei i Chinach, a trzecia w Stanach Zjednoczonych Ameryki.1,9
Merytoryczne uzasadnienie dla zastosowania CTH-O opiera się na wynikach dwóch badań prospektywnych i randomizowanych III fazy z losowym doborem chorych – brytyjskiego (w badaniu znaleźli się też chorzy z Brazylii, Holandii, Niemiec, Nowej Zelandii i Singapuru) MAGIC1,10 i francuskiego ACCORD-07.1,11