Tylko do 29 stycznia bilet na kongres Akademii po Dyplomie NEUROLOGIA kupisz w niższej cenie! Skorzystaj z oferty >
Do badania MAGIC Cunningham i wsp.1,10 zakwalifikowali i poddali analizie ITT 503 chorych na operacyjnego gruczolakoraka żołądka (74%), gruczolakoraka połączenia przełykowo-żołądkowego (około 12%) i gruczolakoraka dolnego odcinka przełyku (około 15%), których losowo przydzielono do ramienia z CTH-O (250) i do ramienia leczonego wyłącznie chirurgicznie (CH – 253 osoby). Chemioterapia składała się z epirubicyny, cisplatyny i fluorouracylu (schemat ECF) podawanych co 21 dni. Trzy cykle CTH-O podano przed zabiegiem operacyjnym, a kolejne 3 po operacji, którą wykonano u 91,6% chorych. W ramieniu CH resekcję wykonano u 96,4% pacjentów. Zakres operacji zależał od chirurga i dlatego limfadenektomię D1 wykonano u około 20% chorych, a limfadenektomię D2 u około 40% (nie podano zakresu limfadenektomii w EC). W badaniu histopatologicznym po operacji w ramieniu CH znaleziono znacznie więcej guzów pT3/T4 (65%) i większą liczbę przerzutowych węzłów chłonnych (pN2/N3 30%) niż w ramieniu z CTH-O (odpowiednio 48% i 16%), co zostało przypisane korzystnemu wpływowi chemioterapii na zmniejszenie wielkości nowotworu (downstaging). W ramieniu CTH-O pełne leczenie ukończyło 42% chorych (34% pacjentów nie otrzymało po operacji chemioterapii z powodu progresji, rezygnacji z leczenia lub powikłań chirurgicznych). Przy medianie obserwacji 49 miesięcy wykazano statystycznie istotne zmniejszenie prawdopodobieństwa progresji choroby (PFS – progression-free survival) pod wpływem CTH-O (HR 0,66; 95% CI 0,53-0,81; p <0,001) oraz ryzyka zgonu (HR 0,75; 95% CI 0,60-0,93; p = 0,009). Przeżycie 5-letnie (OS) wzrosło do 36,3% w ramieniu CTH-O w stosunku do 23% w ramieniu CH. Poważne działania niepożądane (w stopniu 3 i 4) związane z chemioterapią przed- i pooperacyjną wystąpiły u 11% chorych, pod postacią neutropenii (24 i 28%), limfocytopenii (17 i 20%), nudności (6 i 12%), wymiotów (6 i 10%), zapalenia jamy ustnej (4%) i biegunki (3%).1,10
Badanie francuskie ACCORD-071,11 różniło się od badania MAGIC mniejszą ogólną liczbą chorych (224 vs 503), rodzajem chemioterapii okołooperacyjnej (cisplatyna + fluorouracyl podawane co 28 dni vs ECF co 21 dni) i znacznie większą liczbą chorych na EJC (144 – 65% vs 58 – 12%), a mniejszą z GC (55 – 25% vs 372 – 74%). Poza tym założenia, cele, struktura i punkty końcowe obu badań były takie same. Uzyskane wyniki wypadły niemal identycznie. Zabieg chirurgiczny wykonano u 96,5% chorych otrzymujących chemioterapię i u 99% w grupie leczonej wyłącznie operacyjnie. W ramieniu CTH-O w porównaniu z CH całkowite 5-letnie przeżycie uzyskało istotnie więcej chorych – 38% vs 24% (HR dla zgonu, 0,69; 95% CI, 0,50-0,95; p = 0,02) – i 5-letnie przeżycie wolne od choroby (DFS – disease-free survival) okazało się statystycznie znamiennie dłuższe – 34% vs 19% (HR dla progresji, 0,65; 95% CI 0,48-0,89; p = 0,003). W analizie wielowariantowej dodatnimi czynnikami predykcyjnymi dla OS okazały się zastosowanie CTH-O (p = 0,01) i lokalizacja guza w połączeniu przełykowo-żołądkowym (p <0,01). Okołooperacyjna chemioterapia znamiennie zwiększyła resekcyjność z intencją wyleczenia (84% vs 73%; p = 0,04). Ciężkie działania niepożądane związane z chemioterapią wystąpiły u 38% chorych i były podobne do obserwowanych w badaniu MAGIC – najczęstsza była neutropenia (20,2%).1,11
Japońskie badanie randomizowane i prospektywne III fazy ACTS-GC1,12 różniło się w założeniach od badań europejskich. Grupę chorych na operacyjnego GC w II (z wyjątkiem cechy T1) oraz IIIA i IIIB stopniu zaawansowania (zaawansowanie węzłowe wg klasyfikacji japońskiej) z cechami M0 i CY0 (ujemny wynik badania popłuczyn otrzewnowych) poddano radykalnej resekcji żołądka z limfadenektomią co najmniej D2, a następnie losowo przydzielono do obserwacji (ramię CH) lub do pooperacyjnej chemioterapii adiuwantowej (ramię CTH-A) z doustnym lekiem S-1 (preparat zawiera tegafur – pochodną fluorouracylu oraz gimeracyl i oteracyl w stosunku molowym 1:0,4:1, które hamują przemiany pirymidyn: dehydrogenazę dihydropirymidynową i fosforybozylotransferazę kwasu orotowego).
Analiza ITT objęła 1059 chorych. Po 3 latach ryzyko zgonu w ramieniu CTH-A zmniejszyło się o 32% (HR 0,68; 95% CI 0,52-087; p = 0,003). Całkowite przeżycie 5-letnie (OS) i wolne od nawrotu (RFS – relapse-free survival) w całej grupie wyniosło odpowiednio:
- OS CTH-A 71,7% vs CH 61,1%; HR 0,669; 95% CI 0,540-0828 – zmniejszenie ryzyka zgonu o 33,1% po zastosowaniu cytostatyku S-1
- RFS CTH-A 65,4% vs CH 53,1%; HR 0,653; 95% CI 0,537-0,793 – zmniejszenie ryzyka nawrotu GC o 34,7% po zastosowaniu cytostatyku S-1.
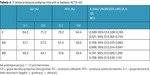
Bardziej szczegółowe dane z rozbiciem na podgrupy zaawansowania zostały przedstawione w tabeli 4.
Badanie ACTS-GC dowiodło korzyści dla przeżycia po podaniu adiuwantowej chemioterapii z pochodną fluoropirymidynowej S-1, choć z obowiązku należy wspomnieć, że japońska klasyfikacja zaawansowania GC różni się od AJCC/UICC, a strategia operacyjna jest bardziej radykalna niż w Europie czy USA. Transponując na klasyfikację AJCC/UICC, 5-letni OS w ramionach CTH-A vs CH uzyska odpowiednio: 83,4% vs 70,8% (II), 68,9% vs 56,2% (IIIA), 43,7% vs 40,1% (IIIB) oraz 45,1% vs 42,7% (IVM0) chorych.1,12
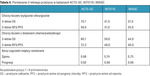
Obniżenie względnego ryzyka zgonu w badaniu ACTS-GC było podobne do uzyskanego w badaniu amerykańskim SWOG 9008/INT 01161,9 z adiuwantową chemioradioterapią oraz w badaniu europejskim MAGIC i ACCORD-07.1,10,11 W tabeli 5 porównano wyniki 3 badań (wyniki badania ACCORD-07 wypadły niemal identycznie jak wyniki MAGIC, dlatego zrezygnowano z dodatkowej kolumny).
Lepsze wyniki uzyskane w badaniu ACTS-GC niektórzy badacze tłumaczą bardziej jednorodną grupą pacjentów (pierwotnie operacyjny rak żołądka z potwierdzonym w badaniu histopatologicznym stadium zaawansowania). W pozostałych dwóch badaniach grupy chorych były niejednorodne, gdyż oprócz chorych na GC włączono do nich również pacjentów z EJC (INT0116 i MAGIC) oraz z EC (MAGIC). Spowodowało to, że w badaniach amerykańskim i europejskim było więcej chorych z guzem T3/T4 (69% i 68%) niż w badaniu japońskim (46%). Potwierdzenie histopatologiczne zajęcia regionalnych węzłów chłonnych po operacji było najmniejsze w badaniu MAGIC (74%), większe w INT0116 (85%) i największe w ACTS-GC (89%).1,9 Zaawansowanie raków po operacji (tzw. patologiczne) w tych trzech badaniach miało więc różny zasięg – największe guzy były w MAGIC i INT0116, a najwięcej przerzutów w węzłach chłonnych w ACTS-GC.
Trudno jednak zgodzić się z interpretacją, że jednorodność grupy badanej miała decydujący wpływ na przeżycie chorych po operacji. Naszym zdaniem główny wpływ na uzyskanie najlepszych wyników przeżyć w badaniu ACTS-GC miały: rodzaj operacji i zakres limfadenektomii (D2) u wszystkich chorych. W pozostałych dwóch badaniach zakres limfadenektomii był suboptymalny – w INT0116 aż w blisko 90%, w MAGIC w >60% (precyzyjnie trudno ustalić, bo nie podano wyniku dla EC).1,9 Nasuwa się zatem wniosek, że gdyby w badaniach INT0116 i MAGIC (a także ACCORD-07) wykonano optymalną limfadenektomię wszystkim chorym, znamienne różnice w przeżyciu na korzyść adiuwantowej chemioradioterapii vs chirurgia (INT0116) lub okołooperacyjnej chemioterapii vs chirurgia (MAGIC, ACCORD-07) prawdopodobnie by nie wystąpiły. Analizując opublikowane wyniki badań (tab. 5), od razu możemy zauważyć, że przeżycie w ramieniu chirurgicznym badania ACST-GC było niemal dwukrotnie lepsze niż w ramieniu z chemioradioterapią INT0116 i ramieniu z chemioterapią okołooperacyjną MAGIC. Ponadto ponad 1/3 chorych w badaniach INT0116 i MAGIC nie ukończyła zaplanowanego leczenia po operacji z powodu progresji raka, nietolerancji lub odmowy dalszego uczestnictwa.1
W styczniu 2015 r. autorzy koreańscy1,13 opublikowali końcowe wyniki randomizowanego prospektywnego badania III fazy ARTIST z losowym doborem chorych, w którym porównywali adiuwantową chemioterapię (XP – kapecytabina + cisplatyna) z adiuwantową chemioradioterapią (XP + 45 Gy) u 458 chorych na operacyjnego raka żołądka (IB – IV M0 wg AJCC) po optymalnej resekcji z limfadenektomią D2. Po 7 latach obserwacji prawdopodobieństwo przeżycia 5 lat wyniosło 73% w ramieniu CTH-A i 75% w ramieniu CTH/RTH-A (p = 0,484), a DFS i OS (odpowiednio HR 0,740; 95% CI 0,520-1,050; p = 0,0922 i HR 1,130; 95% CI 0,775-1,647; p = 0,5272) w obu ramionach nie różniły się istotnie. Po nawrocie raka przeżycie chorych do momentu zgonu wynosiło 9,7 miesiąca w ramieniu CTH-A vs 7,2 miesiąca w ramieniu CTH/RTH-A (p = 0,076). W analizie podgrup zarysował się trend do poprawy DFS w ramieniu z CTH/RTH-A u chorych z podtypem jelitowym GC (HR 0,442; 0,231-0,845; p = 0,01) i z zajęciem węzłów chłonnych regionalnych (HR, 0,700; 0,493-0,994; p = 0,04), co przełożyło się na mniejszą częstość nawrotów miejscowych (7% vs 13%; p = 0,0033), natomiast nie było różnic w odsetku przerzutów odległych między obu ramionami badania (24% vs 27%, p = 0,5568).1,13
Na tej podstawie uważamy, że chorzy na operacyjnego gruczolakoraka żołądka w II i III stopniu zaawansowania klinicznego wg AJCC powinni być leczeni za pomocą radykalnej resekcji (tj. z limfadenektomią D2) i adiuwantowej chemioterapii zawierającej S-1 (populacja azjatycka) lub kapecytabinę i cisplatynę (bez różnic populacyjnych). W przypadku zajęcia większej liczby węzłów chłonnych w materiale pooperacyjnym można rozważyć zastosowanie adiuwantowej chemioradioterapii.1
Podsumowanie
- Chorzy na operacyjnego płaskonabłonkowego raka przełyku o zaawansowaniu II-III wg AJCC powinni być leczeni za pomocą chemioradioterapii neoadiuwantowej z następową radykalną resekcją.
- Chorzy na operacyjnego gruczolakoraka przełyku lub połączenia przełykowo-żołądkowego o zaawansowaniu II-III wg AJCC powinni być leczeni za pomocą okołooperacyjnej chemioterapii lub neoadiuwantowej chemioradioterapii z następową radykalną resekcją.
- Chorzy na operacyjnego gruczolakoraka żołądka o zaawansowaniu II-III wg AJCC powinni być leczeni za pomocą radykalnej resekcji z następową chemioterapią adiuwantową na bazie pochodnej fluoropirymidynowej z cisplatyną. Przy zaawansowaniu pooperacyjnym pN2/N3 w leczeniu adiuwantowym można rozważyć zastosowanie chemioradioterapii zamiast chemioterapii.