- rumień,
- obrzęk,
- uczucie pieczenia,
- złuszczanie martwego naskórka,
- punktowe krwawienie.
Zabieg nacięć podskórnych (subcision)
Zabieg nacięć podskórnych wprowadzono w 1995 roku jako skuteczną metodę leczenia blizn rolling.[19] Takie blizny są nieznacznie zagłębione, o gładkich obrysach, mogą osiągać dość duże rozmiary i często występują zrosty między dnem blizny a warstwą powięziową. Zabieg nacięć podskórnych polega na wprowadzaniu małych igieł w okolice blizny i wykonywaniu nimi określonych ruchów we wszystkich kierunkach. Celem tego zabiegu jest rozbicie włóknistych zrostów. Dodatkowo oderwanie tkanek i wywołanie krwawienia stwarza potencjalną przestrzeń dla odkładania się nowego kolagenu podczas procesu gojenia się ran.[10] Metoda ta wydaje się mało precyzyjna i dość inwazyjna, choć ze względu na prostotę należy o niej wspomnieć. Zabieg nacięć podskórnych osiąga skuteczność notowaną na poziomie 50-60 proc. w leczeniu blizn rolling, a prospektywne, randomizowane badania split-face wykazały, że krótkotrwałe wyniki nacięć podskórnych są lepsze w porównaniu do użycia wypełniaczy, choć wyniki długoterminowe tych dwóch metod są porównywalne.[20,21] W innym badaniu porównano skuteczność samego zabiegu subcision oraz technikę subcision wraz z nieablacyjnym laserem 1320 nm (Nd: YAG) w odstępach dwutygodniowych. Okazało się, że leczenie skojarzone przynosi lepsze rezultaty. Technika subcision poprzez rozluźnianie głębokich mocowań włóknistych sprawia, że blizny są bardziej podatne wobec innych metod leczenia wieloetapowego.[19]
Skin needling (mikroigłowanie)
W tej metodzie wykorzystywane są igły długości 0,5-3 mm. Głębokość nakłucia to 0,1-1,2 mm. W odróżnieniu od subcision narzędzie wprowadza się jedynie w płaszczyźnie pionowej, tworząc kolumny mikrouszkodzeń – podobnie jak przy laseroterapii. Działanie to ma za zadanie rozbicie zwłóknień oraz pobudzenie syntezy kolagenu. Skuteczność tej metody opisywana jest jako redukcja głębokości blizny do 25 proc. po 2 sesjach.[22]
Technika punch
W przypadku głębokich blizn atroficznych, kiedy inne metody nie dają zadowalającego rezultatu, można zastosować technikę punch. Polega ona na wycięciu obszaru blizny i zszyciu rany bądź też wstawieniu przeszczepu w miejsce usuniętej tkanki. Aby uzyskać zadowalający efekt, można tę technikę połączyć z innymi metodami. Na przykład badania Grevelinka wykazały, że doskonałe wyniki można osiągnąć, łącząc punch excision z zabiegiem laserem CO2.[19] Technika ta jest inwazyjna i obarczona ryzykiem odrzucenia przeszczepu, wystąpienia wgłębień czy tworzenia ran tunelowych.
Peeling chemiczny
Peelingi chemiczne były stosowane już przez starożytnych Egipcjan, którzy używali do tego celu tłuszczy zwierzęcych, soli lub alabastru.[23] Brytyjski dermatolog George Miller MacKee zaczął stosować fenol do złuszczania blizn w 1903 roku.[24] Peeling chemiczny to zabieg powodujący celowe chemiczne uszkadzanie naskórka, które w zależności od preparatu prowadzi do złuszczania na różnych poziomach skóry. Podstawą skuteczności jest odpowiednio dobrany preparat przez lekarza z indywidualnie dopasowanym do skóry stężeniem czynnej substancji, od którego zależy głębokość działania peelingu. Wykorzystuje się kwasy: trójchlorooctowy (TCA), glikolowy, migdałowy i in. Peelingi chemiczne nie są polecane do leczenia niespecyficznych rodzajów blizn, gdyż dają niewielką poprawę przy wysokim odsetku działań niepożądanych, jak przebarwienia czy dodatkowe tworzenie się blizn.[25] Nawet przy odpowiednio dobranym stężeniu substancji stopień penetracji nie jest do końca precyzyjny. Bardziej polecaną metodą jest technika CROSS (chemiczna rekonstrukcja blizn skórnych). W tym przypadku stężenie substancji czynnej jest wyższe, a obszar aplikacji jest ograniczony do miejsca występowania blizny.
Wypełnianie tkanek
Wypełnianie tkanek miękkich to kolejny skuteczny zabieg stosowany w powierzchownych bliznach atroficznych polegający na wykonaniu iniekcji substancjami, takimi jak: kwas hialuronowy, hydroksyapatyt wapnia, kwas polimlekowy czy autologiczna tkanka tłuszczowa, aby zastąpić objętościowy ubytek tkankowy, jednocześnie indukując syntezę kolagenu przez pobudzenie fibroblastów.[26]
Autologiczny przeszczep fibroblastów w prospektywnym badaniu z podwójnie ślepą próbą wykazał minimalne działania niepożądane oraz znaczną poprawę sięgającą 64-100 proc. w leczeniu blizn atroficznych.[27]
Przeszczepy autologiczne mają przewagę nad wypełniaczami syntetycznymi ze względu na niski potencjał alergenny. Autotransfer tłuszczu jest procedurą krótszą od autotransferu fibroblastów, lecz często wymaga antybiotykoterapii po zabiegu. Tłuszcz można przeszczepić bezpośrednio, po przefiltrowaniu lub po kilkuminutowym odwirowaniu. Hodowla fibroblastów trwa zwykle kilka tygodni.
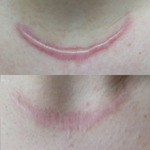
Farmakoterapia iniekcyjna
Iniekcje glikokortykosteroidami to terapia pierwszego rzutu przy wczesnych keloidach[6] (ryc. 3). Głównym sposobem leczenia blizn hipertroficznych są iniekcje glikokortykosteroidami, których działanie ma się opierać na obniżeniu proliferacji fibroblastów oraz pobudzaniu degradacji kolagenu.[28] Zazwyczaj dwie do trzech iniekcji acetonidu triamcynolonu w stężeniu 10-40 mg/ml raz lub dwa razy w miesiącu są wystarczające, by osiągnąć satysfakcjonujące rezultaty.[2] Zabieg z użyciem GKS jest skuteczny z raportowaną poprawą u 75 proc. (6/8) pacjentów oraz całkowitym wygładzeniem 50 proc. (4/8) zmian w odniesieniu do jednego badania.[29] Wystąpienie hipopigmentacji, atrofii i teleangiektazji to potencjalne następstwa zastosowania tej metody.[28] Przy niepowodzeniu steroidoterapii można zastosować 5-fluorouracyl, bleomycynę lub werapamil.[10] Substancje te działają poprzez inhibicję proliferacji fibroblastów.[30] Efekty terapii są różne, choć w większości przypadków obserwuje się 75-proc. poprawę.[10] Działania niepożądane obejmują owrzodzenia w miejscu iniekcji i hiperpigmentację.[30] Wyłączna aplikacja glikokortykosteroidami w kremie bądź maści nie jest rekomendowana.[6]
Istnieją doniesienia o dużej skuteczności połączenia terapii glikokortykosteroidami (acetonid triamcynolonu – TAC) oraz 5-fluorouracylu (5-FU). Leczenie samym cytotoksycznym antymetabolitem w schemacie 50-150 mg/ml cotygodniowo przez 2-4 miesięcy może powodować ból przy i po podaniu, hiperpigmentację, uczucie pieczenia, owrzodzenia, sączenie oraz mogą wystąpić objawy systemowe, takie jak anemia, leukocytopenia, trombocytopenia. Kombinacja tych dwóch substancji pozwala na uzyskanie lepszych efektów przy użyciu mniejszych dawek oraz zminimalizowaniu ryzyka działań niepożądanych. Duże prospektywne, randomizowane badanie kontrolne z udziałem 150 pacjentów poddanych ośmiu iniekcjom 5-FU i TAC w tygodniowych odstępach pokazało skuteczność sięgającą 84 proc., podczas gdy monoterapia GKS wynosiła 68 proc., dodatkowo stwierdzono mniejszy odsetek działań niepożądanych.[31] Wyjaśnienie mechanizmu na poziomie molekularnym pokazuje, że użycie samego TAC hamuje proliferację oraz indukuje zatrzymanie cyklu komórkowego w fazie G1, natomiast użycie dodatkowo 5-FU zatrzymuje cykl w fazie G2 oraz indukuje apoptozę poprzez dalszą aktywację białek p53 i p21.[32] Inne dwa duże badania przeprowadzone na populacji chińskiej wykazały skuteczność sięgającą 90 proc. przy użyciu TAC i 5-FU w dawce 2-5mg/ml. Inhibicja angiogenezy była obserwowana prawie u wszystkich pacjentów, a całkowitą remisję keloidu osiągnięto u 46 proc.[33]
Manuskiatti i Fitzpatrick dowiedli klinicznej poprawy wyglądu blizn hipertroficznych i keloidów po połączeniu iniekcji TAC i zastosowaniu żelu zawierającego wyciąg z cebuli, heparynę i alantoinę, które okazało się skuteczniejsze w porównaniu z zastosowaniem tylko steroidoterapii oraz nie wykazało znaczących działań niepożądanych.[34] Dokonywano prób ostrzykiwania zmian interferonem, jednak ze względu na kosztowność tej metody i skąpe dowody skuteczności nie jest ona rekomendowana.[35]
Radioterapia
Celem radioterapii jest redukcja nadmiernego wzrostu komórkowego i odkładania kolagenu w patologicznym procesie tworzenia się blizny, jednak bez zahamowania tegoż wzrostu w stopniu uniemożliwiającym prawidłowe gojenie się.[35] Terapia ta stosowana jest jako leczenie uzupełniające, leczenie drugiego rzutu oraz w przypadku nawrotów. Praca poglądowa przeprowadzona przez japońskich naukowców pokazuje, że aby uzyskać maksymalną skuteczność przy zachowanym bezpieczeństwie podczas pooperacyjnego naświetlania keloidów u osób dorosłych, należy stosować 10-20 Gy poprzez dzienne dawkowanie frakcjami 5 Gy.[36]. Rekomendowanym obecnie protokołem jest rozpoczęcie naświetlania przy użyciu radioterapii konwencjonalnej, terapii elektronowej lub brachyterapii nie później niż 24 godziny po chirurgicznym usunięciu keloidów – rekomendowaną dawką promieniowania są 2 Gy aplikowane co 1-2 dni, nie przekraczając dawki całkowitej 12 Gy w 6 lub 10 frakcjach [6]. Działania niepożądane takie jak hiper- lub hipopigmentacja, atrofia, rumień, teleangiektazje i suchość skóry są rzadkie, gdy dawka całkowita nie przekracza 12 Gy.[37]